题目内容
7.难溶于水的二硫化亚铁(FeS2)是黄铁矿的主要成分,它溶于稀硝酸的反应为:FeS2+4HNO3=Fe(NO3)3+2S+NO↑+2H2O(1)将反应改写成离子反应方程式FeS2+4H++NO3-=Fe3++2S+NO↑+2H2O.
(2)用标出电子转移方向和数目:FeS2+4HNO3=Fe(NO3)3+2S+NO↑+2H2O
(3)反应中氧化剂是HNO3;还原剂是FeS2.
(4)当反应中转移0.3mol电子,被还原的硝酸的物质的量为0.1mol;可产生标态下NO气体的体积是2.24L.
分析 (1)将硝酸、硝酸铁改写为离子形式;
(2)反应中Fe元素化合价由+2价升高为+3价、S元素化合价由-1价升高为0价,N元素化合价由+5价降低为+2价,转移电子数目为3;
(3)所含元素化合价降低的反应物为氧化剂,所含元素化合价升高的反应物为还原剂;
(4)根据N元素化合价变化计算被还原硝酸物质的量,根据N元素计算生成NO物质的量,根据V=nVm计算NO体积.
解答 解:(1)反应FeS2+4HNO3=Fe(NO3)3+2S+NO↑+2H2O改写为离子方程式:FeS2+4H++NO3-=Fe3++2S+NO↑+2H2O,
故答案为:FeS2+4H++NO3-=Fe3++2S+NO↑+2H2O;
(2)反应中Fe元素化合价由+2价升高为+3价、S元素化合价由-1价升高为0价,N元素化合价由+5价降低为+2价,转移电子数目为3,标出电子转移数目与方向为: ,
,
故答案为: ;
;
(3)HNO3中N元素化合价由+5价降低为+2价,故HNO3是氧化剂,Fe元素化合价由+2价升高为+3价、S元素化合价由-1价升高为0价,FeS2是还原剂,
故答案为:HNO3;FeS2;
(4)HNO3中N元素化合价由+5价降低为+2价,反应中转移0.3mol电子,被还原的硝酸的物质的量为$\frac{0.3mol}{3}$=0.1mol,根据N元素可知生成NO为0.1mol,标况下NO体积为0.1mol×22.4L/mol=2.24L,
故答案为:0.1mol;2.24.
点评 本题考查氧化还原反应基本概念、计算、电子转移表示以及离子方程式书写,关键是根据元素化合价变化进行分析解答.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
18.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
2.如图下列仪器,可以直接加热的是( )
| A. | 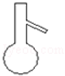 | B. |  | C. |  | D. |  |
19.已知短周期元素的四种离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中正确的是( )
| A. | 原子序数 d>c>b>a | |
| B. | 单质的还原性D<C<B<A | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A |
16.反应2SO2+O2$?_{△}^{催化剂}$2SO3经一段时间后,SO3的浓度增加了0.8mol•L-1,在这段时间内用O2表示的反应速率为0.04mol•L-1•s-1,则这段时间为( )
| A. | 0.1 s | B. | 2.5 s | C. | 5 s | D. | 10 s |
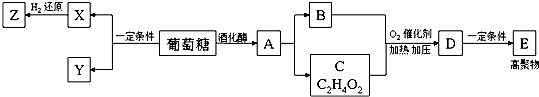
 .
. .
. .
.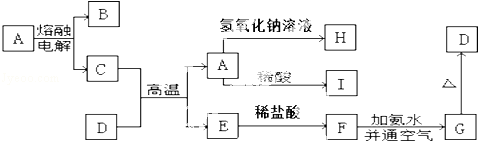
 化工厂生产盐酸的主要过程是:
化工厂生产盐酸的主要过程是: 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白:
铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜.某化学研究小组在实验室中按下列步骤模拟该生产过程,装置如图.填写下列空白: