题目内容
下列离子方程式正确的是( )
| A、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | ||||
B、用惰性电极电解MgCl2溶液:2Mg2++2H2O
| ||||
| C、向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | ||||
| D、Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氢氧化钠过量,碳酸氢根离子和铵根离子都完全反应;
B.电解氯化镁溶液,阳极放电的是水电离的氢离子,镁离子不会放电;
C.硝酸根离子在酸性条件下能够碘离子,由于碘化氢足量,硝酸根离子和铁离子都完全反应;
D.酸性高锰酸钾溶液具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子、
B.电解氯化镁溶液,阳极放电的是水电离的氢离子,镁离子不会放电;
C.硝酸根离子在酸性条件下能够碘离子,由于碘化氢足量,硝酸根离子和铁离子都完全反应;
D.酸性高锰酸钾溶液具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子、
解答:
解:A.NH4HCO3溶液与过量NaOH溶液反应生成碳酸钠、一水合氨和水,正确离子方程式为:HCO3-+NH4++2OH-=NH3.H2O+H2O+CO32-,故A错误;
B.用惰性电极电解MgCl2溶液,镁离子不会放电,电解的实质为电解水,正确的电解方程式为:2H2O
O2↑+2H2↑,故B错误;
C.向Fe(NO3)3溶液中加入过量的HI溶液,碘化氢过量,硝酸根离子在酸性条件下具有氧化性,能够氧化碘离子,正确的离子方程式为:10I-+3NO3-+Fe3++12H+═5I2+3NO↑+Fe2++6H2O,故C错误;
D.酸性高锰酸钾溶液具有强氧化性,能够与亚硫酸钠发生氧化还原反应,使酸性KMnO4溶液褪色,反应的离子方程式为:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故D正确;
故选D.
B.用惰性电极电解MgCl2溶液,镁离子不会放电,电解的实质为电解水,正确的电解方程式为:2H2O
| ||
C.向Fe(NO3)3溶液中加入过量的HI溶液,碘化氢过量,硝酸根离子在酸性条件下具有氧化性,能够氧化碘离子,正确的离子方程式为:10I-+3NO3-+Fe3++12H+═5I2+3NO↑+Fe2++6H2O,故C错误;
D.酸性高锰酸钾溶液具有强氧化性,能够与亚硫酸钠发生氧化还原反应,使酸性KMnO4溶液褪色,反应的离子方程式为:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故D正确;
故选D.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;选项C为易错点,注意硝酸根离子在酸性条件下具有强氧化性.

练习册系列答案
相关题目
下列离子方程式,正确的是( )
| A、在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O |
| B、碳酸钠溶液中加入二氧化硅:CO32-+SiO2═SiO32-+CO2↑ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |
一氧化碳、烯烃和氢气在催化剂作用下发生烯烃的醛化反应,又叫羰基的合成.如由乙烯可制丙醛:CH2=CH2+CO+H2→CH3CH2CHO,由丁烯进行醛化反应也可得到醛,在它的同分异构体中属于醛的共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
| A、神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| B、食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
| C、人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D、针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 |
下列关于有机物的说法正确的是( )
| A、苯乙烯分子中所有原子可能在同一个平面上 |
| B、分子式为C7H8O且分子中有苯环有机物共有4种 |
| C、乙醇和甘油互为同系物 |
| D、除去乙醇中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 |
设为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A、100mL 18mol?L-1浓硫酸与足量铜反应,转移电子数为1.8NA |
| B、0.5L 0.2mol?L-1氯化铁溶液中Fe3+数目为0.1NA |
| C、0.4mol SiO2晶体中所含的共价键数目为1.6NA |
| D、已知t℃时,MgCO3的K=4.0×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA |
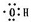 ;
;