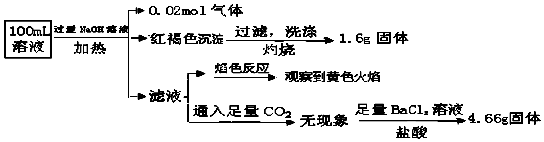
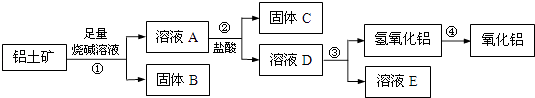
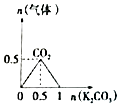��Ŀ����
����Ŀ������Ҫ��ش����⣺
��1����ijNaOH��Һ��Ͷ��һ��Al��������������������������ݣ���������ݵ����ӷ�Ӧ����ʽΪ ��
��2��ʵ���ҳ��û�ԭ��Fe����ˮ������Ӧ��ʵ�����о�Fe�Ļ�ԭ�ԣ���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ ��
��3��Fe��OH��2�Ʊ�ʱ�����õķ����ǡ����ιܡ�Һ���¡���ʵ�����������ʵ��ʱ�����ڲ������������ɻ���ְ�ɫ����������ɫ����ֱ�����ձ�Ϊ���ɫ������д����ɫ��������ת��Ϊ���ɫ�����Ļ�ѧ��Ӧ����ʽΪ ��
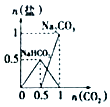
��4��ʵ��ʱ�Ʊ�Al��OH��3ʱ�����ÿ��������Σ���Al2��SO4��3�백ˮ��Ӧ�����Ʊ���ij����С����ʵ��ʱ������Al2��SO4��3��Һ�м����˹���NaOH��Һ�����ղ�û���Ƴ���ɫ����Al��OH��3 �� ���С��ͬѧʵ��ʱ�����������ӷ�Ӧ����ʽΪ ��
���𰸡�
��1��2Al+2OH��+2H2O=2AlO2��+3H2��
��2��3Fe+4H2O��g�� ![]() Fe3O4+4H2
Fe3O4+4H2
��3��4Fe��OH��2+O2+2H2O=4Fe��OH��3
��4��Al3++4OH��=AlO2��+2H2O
���������⣺��1����ijNaOH��Һ��Ͷ��һ��Al�������������������������������������������Һ��Ӧ����ƫ�����ƺ���������������ݵ����ӷ�Ӧ����ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2����
���Դ��ǣ�2Al+2OH��+2H2O=2AlO2��+3H2������2��ʵ���ҳ��û�ԭ��Fe����ˮ������Ӧ��ʵ�����о�Fe�Ļ�ԭ�ԣ�����ˮ������Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe+4H2O��g�� ![]() Fe3O4+4H2��
Fe3O4+4H2��
���Դ��ǣ�3Fe+4H2O��g�� ![]() Fe3O4+4H2����3����ɫ��������ת��Ϊ���ɫ�����������������������е�������������������������Ӧ�Ļ�ѧ����ʽΪ��4Fe��OH��2+O2+2H2O=4Fe��OH��3 ��
Fe3O4+4H2����3����ɫ��������ת��Ϊ���ɫ�����������������������е�������������������������Ӧ�Ļ�ѧ����ʽΪ��4Fe��OH��2+O2+2H2O=4Fe��OH��3 ��
���Դ��ǣ�4Fe��OH��2+O2+2H2O=4Fe��OH��3 ����4����Al2��SO4��3��Һ�м����˹���NaOH��Һ��������ӦΪ������������������������������������������������������ǿ������ƫ�����ƣ���Ӧ�������ӷ���ʽΪ��Al3++4OH��=AlO2��+2H2O��
���Դ��ǣ�Al3++4OH��=AlO2��+2H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�