��Ŀ����
����Ŀ���ο���ͼ����Ҫ��ش��������⣺ 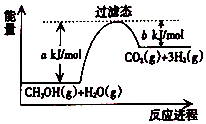
��1���״����ӽ���Ĥȼ�ϵ�ؽ��״�����ת��Ϊ������һ��ԭ����CH3OH��g����H2O��Ӧ����CO2��H2 �� ���ڷ�Ӧ��ϵ�м����������Ӧ������������Ӧ��� a�ı仯�������������С���������䡱������Ӧ�ȡ�H�ı仯�������������С���������䡱������д��CH3OH��g����H2O��g����Ӧ���Ȼ�ѧ����ʽ ��
��2���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ��������һ�ַ�Ӧԭ���ǣ�
CH3OH��g��+ ![]() O2��g��CO2��g��+2H2��g����H=��c kJ/mol
O2��g��CO2��g��+2H2��g����H=��c kJ/mol
��֪H2O��g��H2O��l����H=��d kJ/mol��
��״�ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
���𰸡�
��1����С�����䣻CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol
��2��CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��2a��2b+3c+2d��kJ/mol
O2��g��=CO2��g��+2H2O��l����H=��2a��2b+3c+2d��kJ/mol
���������⣺��1���������ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���a��С�����������ܸı��ܣ�����Ӧ�ȡ�H���䣬��Ӧ����ͼ������������������ڷ�Ӧ�������������Ϊ���ȷ�Ӧ����ͼ��֪��1mol �״���1mol ˮ������Ӧ����CO2���������յ�����Ϊ��a��b��kJ����Ӧ�Ȼ�ѧ����ʽΪ��CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol���ʴ�Ϊ����С�� ���䣻CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol����2����֪����CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2��g����H=c kJ/mol��
O2��g��=CO2��g��+2H2��g����H=c kJ/mol��
��H2O��g��=H2O��l����H=d kJ/mol����CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol�����ݸ�˹���ɢ١�3��2�����۩��ڣ��ɵã�CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��2a��2b+3c+2d��kJ/mol���ʴ�Ϊ��CH3OH��g��+
O2��g��=CO2��g��+2H2O��l����H=��2a��2b+3c+2d��kJ/mol���ʴ�Ϊ��CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��2a��2b+3c+2d��kJ/mol��
O2��g��=CO2��g��+2H2O��l����H=��2a��2b+3c+2d��kJ/mol��
��1���������ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���a��С�����������ܸı��ܣ�����Ӧ�ȡ�H���䣮����ͼ���֪��Ӧ��=akJ/mol��bkJ/mol������CH3OH��g����H2O��g����Ӧ���Ȼ�ѧ����ʽΪCH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol����2����֪������CH3OH��g��+ ![]() O2��g��=CO2��g��+2H2��g����H=c kJ/mol����H2O��g��=H2O��l����H=d kJ/mol����CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol�����ݸ�˹���ɢ١�3��2�����۩��ڣ��ɵã�
O2��g��=CO2��g��+2H2��g����H=c kJ/mol����H2O��g��=H2O��l����H=d kJ/mol����CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H=+��a��b��kJ/mol�����ݸ�˹���ɢ١�3��2�����۩��ڣ��ɵã�

����Ŀ����ͼ������������̽��SO2�����ʣ�ʵ��ʱ��Na2SO3�����ϵμ���Ũ���ᣬ��������һ����������档���ж�ʵ���������������Ͳ���ȷ����

ѡ�� | ʵ������ | ���� |
A | BaCl2��Һ����� | SO2��BaCl2��Һ��Ӧ������BaSO3���� |
B | Na2S��Һ����� | SO2��Na2S��Һ��Ӧ������S���� |
C | ����KMnO4��Һ��ɫ | SO2���л�ԭ�� |
D | Ʒ����Һ��ɫ | SO2����Ư���� |
A. A B. B C. C D. D


