题目内容
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1) 上述实验中发生反应的化学方程式有:
__________________、_____________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________;
(4) 要加快上述实验中气体产生的速率,还可以采取的措施有:
_____________________、___________________________(举两种)。
(5) 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下的一系列的实验。将表中所给的混合溶液分别加到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需要的时间。
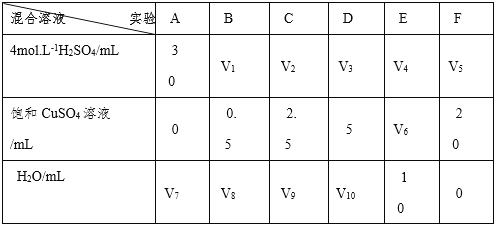
①请完成此实验设计,其中:V1 =____;V6 = ____;V9=____;
②反应一段时间后,实验E中的金属呈____色;
③该同学最后得出结论为:当加入少量硫酸铜溶液时,生成氢气的速率会大大提高,但当加入的硫酸铜溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:______________________________________;
【答案】 Zn+CuSO4=ZnSO4+Cu Zn+H2SO4=ZnSO4+H2↑ 锌置换出的铜附着在锌上,并与稀硫酸构成原电池,使反应加快 Ag2SO4 升高反应温度,适当提高硫酸的浓度,用锌粉替代锌粒(选二作答) 30 10 17.5 暗红色 等 当硫酸铜溶液超过一定量时,生成的铜沉积在锌的表面上,降低了锌与溶液的接触面积
【解析】(1)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,此外金属锌会和硫酸之间发生反应Zn+H2SO4=ZnSO4+H2↑,故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,故答案为:CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率;(3)Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4,故答案为:Ag2SO4;(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,故答案为:升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等;(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同。A组中硫酸为30ml,那么其它组硫酸量也都为30ml,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml;故答案为:30;10;17.5;②锌与铜离子反应生成的铜单质附着在锌粒的表现灰黑,铜为红色金属,因此当铜积累到一定量后,锌粒表面呈红色,故答案为: 暗红;③因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降。故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】一定条件下,可逆反应2A![]() B+3C,在以下四种情况中处于平衡状态的是( )
B+3C,在以下四种情况中处于平衡状态的是( )
正反应速率 | 逆反应速率 | |
A | v(A)=2 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
B | v(A)=2 mol·L-1·min-1 | v(C)=2 mol·L-1·min-1 |
C | v(A)=1 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
D | v(A)=1 mol·L-1·min-1 | v(C)=1.5 mol·L-1·min-1 |
A. A B. B C. C D. D
