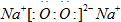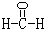题目内容
由A、B两种元素组成的两种单质A2、B2和一种共价化合物AB,A元素在AB中显正价.
(1)若B原子在同族元素中原子半径最小时,则A元素为________,B元素为________,AB化学式为________.
(2)按B所代表的元素的核电荷数递增的顺序,4种AB型化合物的化学式依次为________、________、________、________.其中分子中键的极性最强的应是________;它们以相等的物质的量溶于等量的水中,所得溶液酸性最强的是________,酸性最弱的是________.
答案:
解析:
解析:
|
答案:(1)H F HF (2)HF HCl HBr HI HF HI HF 解析:(1)A2、B2都是双原子分子,预计它们应该是气态分子;AB是共价化合物,AB中A元素显正价,若是+1价,则为H元素;B原子在同族中原子半径最小时,B为F元素. (2)B还可以是Cl、Br、I元素之一,它们也都能与H形成AB型共价化合物. (3)HF、HCl、HBr、HI中,F的非金属性最强,吸引电子的能力最强,HF分子中共用电子对偏离H原子的程度最大,H-F键极性最强. HX(X代表卤素)水溶液的酸性,按X原子序数的增加而增强,其中HI(aq)的酸性最强、HF(aq)的酸性最弱——氢氟酸是弱酸,其他氢卤酸都是强酸. |

练习册系列答案
相关题目
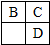 A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )| A、简单离子的半径大小关系:B>C>E | B、C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故 | C、由A、B两种元素组成的离子化合物NH5中,阴、阳离子个数比为1:1 | D、由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生沉淀 |