题目内容
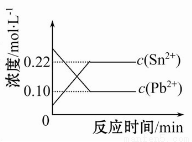
向一容积为1 L的密闭容器中加入一定量的X、Y,发生反应aX(g)+2Y(s) bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。

根据以上信息,下列说法正确的是 ( )。
A.用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol·L-1·min-1
B.根据上图可求得化学方程式中a∶b=1∶3
C.推测在第7 min时曲线变化的原因可能是升温
D.推测在第13 min时曲线变化的原因可能是降温
C
【解析】 本题通过图像的信息来考查反应速率的计算以及平衡移动的影响因素等。
Δc(X)=(0.45-0.20)mol·L-1=0.25 mol·L-1,则v(X)=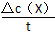 =0.025 mol·L-1·min-1;10~13 min时,各种成分的浓度不再改变,则此时反应达到平衡状态,Δc(X)=0.25 mol·L-1,Δc(Z)=0.5 mol·L-1,而Δc(X)∶Δc(Z)=a∶b,故a∶b=1∶2;在第7 min时,X的浓度减小更快,Z的浓度增大更快,即反应速率加快了,所以可能是升高温度或者加入催化剂,此时不能通过平衡移动原理来解释,因为还没有达到平衡状态;第13 min时,平衡被破坏,Z的浓度减小,平衡逆向移动,原因可能是升高温度。
=0.025 mol·L-1·min-1;10~13 min时,各种成分的浓度不再改变,则此时反应达到平衡状态,Δc(X)=0.25 mol·L-1,Δc(Z)=0.5 mol·L-1,而Δc(X)∶Δc(Z)=a∶b,故a∶b=1∶2;在第7 min时,X的浓度减小更快,Z的浓度增大更快,即反应速率加快了,所以可能是升高温度或者加入催化剂,此时不能通过平衡移动原理来解释,因为还没有达到平衡状态;第13 min时,平衡被破坏,Z的浓度减小,平衡逆向移动,原因可能是升高温度。

相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是 ( )。
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③