题目内容
硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫.(1)工业制硫酸的过程中,SO2被氧气氧化的化学方程式为
(2)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫.
已知:25℃时,H2SO3?HSO3-+H+K=1.5×10-2
H2CO3?HCO3-+H+K=4.4×10-7
①下列试剂中适合用作该法吸收剂的是
a.石灰乳 b.Na2SO3溶液 c.Na2CO3溶液
②“钠碱法”用NaOH溶液作吸收剂,向100mL 0.2mol?L-1的NaOH溶液中通入标准状况下0.448L SO2气体,反应后测得溶液pH<7,则溶液中下列各离子浓度关系正确的是
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
(3)某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品.具体流程如下:
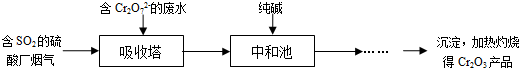
①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为
②中和池中的反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式为
分析:(1)SO2催化氧化成SO3,该反应是可逆反应;
(2)①根据脱硫的原理,适合用作该法吸收剂的是能与SO2发生反应的物质;
②n(SO2)=
=0.02mol,n(NaOH)=0.1L×0.2mol/L=0.02mol,二者反应的化学方程式为:SO2+NaOH=NaHSO3,反应后测得溶液pH<7,NaHSO3溶液呈酸性,说明HSO3-电离程度大于水解程度,结合溶液的电中性原则、物料守恒以及质子守恒解答该题;
(3)①二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
②碳酸盐和酸反应生成二氧化碳和水;
(2)①根据脱硫的原理,适合用作该法吸收剂的是能与SO2发生反应的物质;
②n(SO2)=
| 0.448L |
| 22.4L/mol |
(3)①二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
②碳酸盐和酸反应生成二氧化碳和水;
解答:解:(1)SO2被氧气氧化,硫的化合价升高,SO2体现还原性,催化氧化成SO3,化学方程式为:2SO2+O2
2SO3,
故答案为:2SO2+O2
2SO3;
(2)①a.石灰乳的主要成分为氢氧化钙,SO2+Ca(OH)2=CaSO3+H2O,故a正确;
b.二氧化硫与亚硫酸钠溶液反应生成亚硫酸氢钠,反应方程式为:H2O+Na2SO3+SO2═2NaHSO3,故b正确;
c.亚硫酸的酸性强于碳酸,所以二氧化硫能与Na2CO3溶液反应,SO2+Na2CO3=Na2SO3+CO2,故C正确;
故答案为:a、b、c;
②n(SO2)=
=0.02mol,n(NaOH)=0.1L×0.2mol/L=0.02mol,二者反应的化学方程式为:SO2+NaOH=NaHSO3,
a、亚硫酸是弱酸,反应后测得溶液pH<7,NaHSO3溶液呈酸性,说明HSO3-电离程度大于水解程度,即c(SO32-)>c(H2SO3),NaHSO3溶液是盐溶液,电离出钠离子和亚硫酸氢根离子,HSO3-电离和水解程度相对于亚硫酸钠的电离都比较小,所以c(HSO3-)>c(SO32-)>c(H2SO3),故a正确;
b、NaHSO3溶液是盐溶液,电离出钠离子和亚硫酸氢根离子,因HSO3-电离和水解,所以c(Na+)>c(HSO3-),NaHSO3溶液pH<7,所以c(H+)>c(SO32-),故
b正确;
c、溶液中一定存在电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数即:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故c错误;
故答案为:a、b;
(3)①重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
②中和池中加入碳酸钠和酸反应,除生成Cr(OH)3沉淀外,还会产生二氧化碳气体,
故答案为:CO2;
| 催化剂 |
| △ |
故答案为:2SO2+O2
| 催化剂 |
| △ |
(2)①a.石灰乳的主要成分为氢氧化钙,SO2+Ca(OH)2=CaSO3+H2O,故a正确;
b.二氧化硫与亚硫酸钠溶液反应生成亚硫酸氢钠,反应方程式为:H2O+Na2SO3+SO2═2NaHSO3,故b正确;
c.亚硫酸的酸性强于碳酸,所以二氧化硫能与Na2CO3溶液反应,SO2+Na2CO3=Na2SO3+CO2,故C正确;
故答案为:a、b、c;
②n(SO2)=
| 0.448L |
| 22.4L/mol |
a、亚硫酸是弱酸,反应后测得溶液pH<7,NaHSO3溶液呈酸性,说明HSO3-电离程度大于水解程度,即c(SO32-)>c(H2SO3),NaHSO3溶液是盐溶液,电离出钠离子和亚硫酸氢根离子,HSO3-电离和水解程度相对于亚硫酸钠的电离都比较小,所以c(HSO3-)>c(SO32-)>c(H2SO3),故a正确;
b、NaHSO3溶液是盐溶液,电离出钠离子和亚硫酸氢根离子,因HSO3-电离和水解,所以c(Na+)>c(HSO3-),NaHSO3溶液pH<7,所以c(H+)>c(SO32-),故
b正确;
c、溶液中一定存在电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数即:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故c错误;
故答案为:a、b;
(3)①重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
②中和池中加入碳酸钠和酸反应,除生成Cr(OH)3沉淀外,还会产生二氧化碳气体,
故答案为:CO2;
点评:本题考查了硫酸工厂的烟气中烟气脱硫,涉及了二氧化硫性质、离子浓度大小的比较、重铬酸根的强氧化性等内容的应用,侧重考查了学生的分析、理解等综合能力,注意合理分析题中信息,对于离子浓度大小的比较,确定溶液中的溶质及物质的量的关系是解答的关键,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目


 HSO3 -+H+
K=1.5×10-2
HSO3 -+H+
K=1.5×10-2