题目内容
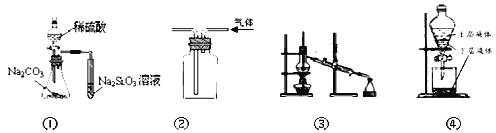
【题目】Ⅰ.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
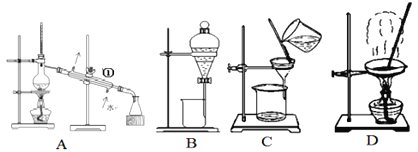
(1)从碘水中分离出I2,选择装置_______(填代表装置图的字母);该分离方法的名称为_______。
(2)A中装置①的名称是________,该装置通常不选择球形冷凝管和蛇形冷凝管的原因是:_______。下列操作与上图A采用同一原理的是______(填选项代号)
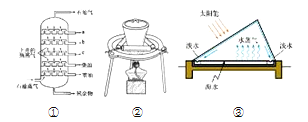
(3)利用装置C对过滤所得的固体洗涤的具体操作方法是:________。
Ⅱ.硫酸试剂瓶标签上的内容:
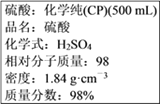
(1)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则配制稀硫酸时需要取________mL的该硫酸;配制时需选用的仪器主要有量筒、烧杯、玻璃棒、__________、__________(在横线上填写所缺仪器的名称)。
(2)配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是_______(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
Ⅲ.为测定某含有杂质Na2O的Na2O2样品的纯度,实验小组设计如下方案。将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
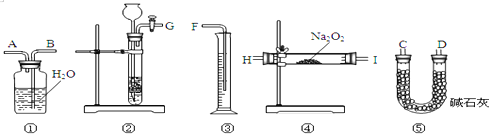
(1)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是______。(填写仪器编号,不重复使用。)
(2)装置①⑤的作用分别是:①___________⑤________。
【答案】B 萃取、分液 冷凝管 球形冷凝管和蛇形冷凝管可以存留部分冷凝液体 ①③ 用玻璃棒引流向漏斗中加入蒸馏水至刚好没过固体,过滤,重复操作2~3次 62.5 250mL容量瓶 胶头滴管 将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下12cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切 ②④⑤①③ 排水法收集O2 除去O2中混有的CO2气体(或CO2与HCl)
【解析】
(1)从碘水中分离出I2,碘易溶于有机溶剂而难溶于水,所以可以采用萃取方法将碘从碘水中提取,然后采用分液方法分离,答案选B;
(2)装置A中①的名称是冷凝管,该装置通常不选择球形冷凝管和蛇形冷凝管的原因是球形冷凝管和蛇形冷凝管可以存留部分冷凝液体,不能用于组装成蒸馏装置,所示操作与图A采用同一原理的是滤液沸点不同分离混合物的操作为蒸馏,故所示操作与A采用同一原理的是①③;
(3)利用装置C对过滤所得的固体洗涤的具体操作方法是:用玻璃棒引流向漏斗中加入蒸馏水至刚好没过固体,过滤,重复操作2~3次;
Ⅱ. (1)浓硫酸的浓度是![]() =18.4mol/L,需要240mL4.6mol·L1的稀硫酸,应选择250mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得,V×18.4mol/L=250mL×4.6mol/L,解得V=62.5mL;配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、胶头滴管、玻璃棒、烧杯、250mL容量瓶;其中配制稀硫酸溶液时定容的操作为将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下12cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
=18.4mol/L,需要240mL4.6mol·L1的稀硫酸,应选择250mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得,V×18.4mol/L=250mL×4.6mol/L,解得V=62.5mL;配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、胶头滴管、玻璃棒、烧杯、250mL容量瓶;其中配制稀硫酸溶液时定容的操作为将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下12cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
(2)①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶,会导致溶质的量偏多,则浓度偏高,故①符合题意;
②容量瓶使用时未干燥,对浓度无影响,故②不符合题意;
③溶解后未经冷却就移液,则冷却后溶液体积偏小,浓度偏高,故③符合题意;
④定容时不小心有少量蒸馏水滴到瓶外,不会有影响溶质和溶液体积,则浓度不变,故④不符合题意;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,导致所配溶液的体积偏大,导致最终结果偏小,故⑤不符合题意;
答案选①③;
Ⅲ. (1) 将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量,实验装置设计为先利用装置②制备二氧化碳,通过装置④和样品中过氧化钠反应,通过装置⑤除去过量的二氧化碳,利用①③采取排水量气方法测定生成氧气的体积,导管应短进长出;仪器的连接顺序为:②④⑤①③;
(2) 装置⑤是利用碱石灰除去氧气中过量的二氧化碳气体,避免影响氧气的体积测定,装置①和③联合起来采取排水量气方法测定生成氧气的体积。

【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中![]() 假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计![]() ,使其达到分解平衡:
,使其达到分解平衡:![]() 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应![]() 、
、![]() ,所以在低温下自发进行
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算![]() 时的分解平衡常数约为
时的分解平衡常数约为![]()
【题目】乙烯的产量是衡量一个国家石油化工水平的重要标志。工业上常用丁烷裂解制备乙烯。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2
CH4(g)+C3H6(g) ΔH2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下儿种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①上述反应中,ΔH1=___kJ·mol-1。
②若忽略副反应,相同条件下采用异丁烷裂解制取一定量的乙烯,其能耗比采用正丁烷__(填“高”或“低”)。
(2)一定温度下,在恒压密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是___(填代号)。
a.气体密度保持不变
b.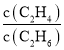 保持不变
保持不变
c.ΔH不变
d.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,可采用的措施是__。
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。
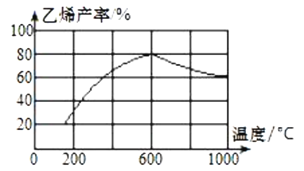
温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是__。
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,容器内压强为P0,反应生成乙烯和乙烷,经过10min达到平衡状态,此温度下用各组分的分压表示的平衡常数K(p)=0.5P0用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),则0~10min内乙烯的生成速率v(C2H4)为__mol·L-1。