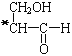题目内容
【题目】(1) 指出下列元素在周期表中的位置:硅在第_____周期第______族;氟在第_____周期第______族。
(2)写出下列物质的电子式:
氮气________;氯化镁_________;二氧化碳_______;氟化氢______
【答案】三 ⅣA 二 ⅦA ![]()
![]()
![]()
![]()
【解析】
(1)Si的原子序数为14、氟的原子序数为9,结合原子结构示意图分析在元素周期表中的位置;
(2)氮气、二氧化碳和氟化氢均只含有共价键,而氯化镁只含有离子键,据此写出它们的电子式;
(1)Si的原子序数为14,其原子结构示意图为![]() ,则Si在元素周期表中的位置为第三周期ⅣA族;氟的原子序数为9,其原子结构示意图为
,则Si在元素周期表中的位置为第三周期ⅣA族;氟的原子序数为9,其原子结构示意图为![]() ,则F在元素周期表中的位置为第二周期ⅦA族;
,则F在元素周期表中的位置为第二周期ⅦA族;
(2)氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为![]() ;氯化镁属于离子化合物,电子式中需要标出阴阳离子所带电荷,镁离子直接用离子符号表示,氯离子需要标出最外层电子,MgCl2的电子式为
;氯化镁属于离子化合物,电子式中需要标出阴阳离子所带电荷,镁离子直接用离子符号表示,氯离子需要标出最外层电子,MgCl2的电子式为![]() ;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:![]() ;氟化氢为共价化合物,氢原子与氟原子形成了一个共用电子对,HF的电子式为
;氟化氢为共价化合物,氢原子与氟原子形成了一个共用电子对,HF的电子式为![]() 。
。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中的位置 。
(2)实验室制取X元素的氢化物的化学方程式为 。
(3)W、Z的最高价氧化物对应的含氧酸的酸性大小顺序 (用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为 。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为 。
【题目】下列各项操作或现象能达到预期实验目的的是
选项 | 操作或现象 | 实验目的 |
A | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
B | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br—还原性强于Cl— |
C | 将氯化亚铁固体溶于适量蒸馏水中 | 配制FeCl2溶液 |
D | 将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶 | 除去氯气中的HCl气体 |
A. A B. B C. C D. D