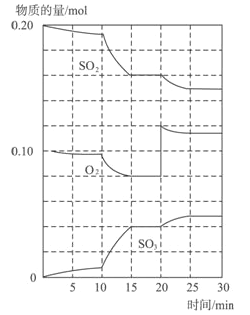
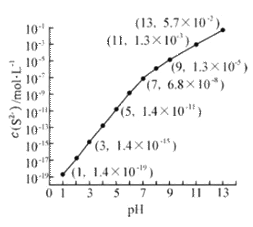题目内容
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH和ROH分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
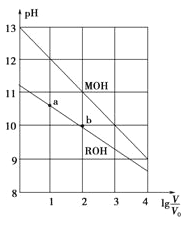
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
【答案】D
【解析】
试题分析:A、根据图像可知,0.1mol/L MOH溶液的pH=13,说明MOH完全电离,为强电解质,而ROH溶液的pH<13,说明ROH为弱电解质,所以MOH的碱性强于ROH的碱性。A正确;B、ROH为弱碱,溶液越稀越易电离,所以ROH的电离程度:b点大于a点。B正确;C、两溶液无限稀释下去,最终的pH均为7,所以它们的氢氧根离子浓度相等。C正确;D、当![]() =2时,MOH溶液的pH=11,ROH溶液的pH=10,MOH溶液中不存在电离平衡,升高温度,对c(M+)无影响;而ROH溶液中存在电离平衡,升高温度,电离正向移动,则c(R+)浓度增大。综上所述,升高温度时
=2时,MOH溶液的pH=11,ROH溶液的pH=10,MOH溶液中不存在电离平衡,升高温度,对c(M+)无影响;而ROH溶液中存在电离平衡,升高温度,电离正向移动,则c(R+)浓度增大。综上所述,升高温度时![]() 比值减小,D错误。答案选D。
比值减小,D错误。答案选D。

练习册系列答案
相关题目