题目内容
【题目】研究硫元素及其化合物的性质具有重要意义。
Ⅰ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
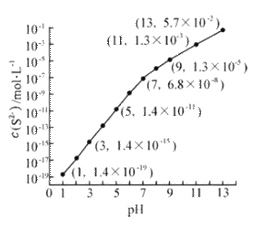
Ⅱ.在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(Q>0)
2SO3(g)(Q>0)
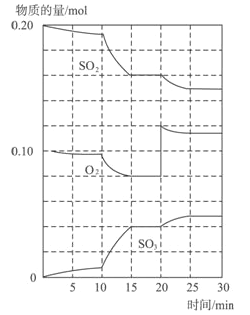
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____________。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是______________(用文字表达)10min到15min的曲线变化的原因可能是______________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量.
【答案】Ⅰ.(1)①0.043 ② 5
Ⅱ.(1)15—20min和 25-30min (正确但不全给1分)
(2)增加了氧气的量(或者说出0.04 mol的O2) a、b(正确但不全给1分)
【解析】
试题分析:(1)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol/LH2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1mol/L-5.7×10-2mol/L =0.043mol/L;
②Mn2+开始沉淀溶液中硫离子浓度为![]() ,因此根据图像可知此时pH=5;
,因此根据图像可知此时pH=5;
Ⅱ.(1)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态;
(2)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度。由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变。a.加了催化剂,增大反应速率,a正确;b.缩小容器体积,增大压强,增大反应速率,b正确;c.降低温度反应速率降低,c错误;d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,d错误,答案选ab。