题目内容
【题目】A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。
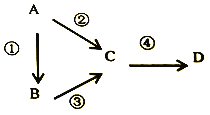
(1)若A是一种淡黄色固体,B是气态氢化物,C、D 为气态氧化物,且C是形成酸雨的主要物质。请写 出 C与 B反应的化学方程式_________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式_________。实验室中检验气体B存在用的试剂或用品为_________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱瑢液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________。请写出②的离子方程式_________。
(4)若C是一种淡黄色固体,常用于呼吸面具中的供氧剂,D是一种强碱。写出反应 ④的离子方程式_________。
【答案】 2H2S+SO2=3S+2H2O 4NH3+5O2![]() 4NO+6H2O 湿润的红色石蕊试纸 第3周期第ⅢA族 2A1+2OH-+6H2O=2[A1(OH)4]- +3H2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑
4NO+6H2O 湿润的红色石蕊试纸 第3周期第ⅢA族 2A1+2OH-+6H2O=2[A1(OH)4]- +3H2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑
【解析】试题分析:(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质,则符合条件的应该是A是S,B是H2S,C是SO2,D是SO3。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因,这说明是氮元素及其化合物的转化,因此A是氮气,B是氨气,C是NO,D是NO2。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,这说明该转化是铝及其化合物的转化,因此符合条件的是A是Al,B是氧化铝,C是偏铝酸钠,D是氢氧化铝。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱,因此C是过氧化钠,D是氢氧化钠。
解析:根据以上分析,(1) H2S具有还原性,SO2具有氧化性,二者可以发生氧化还原反应生成单质硫和水,反应的化学方程式为2H2S+SO2=3S+2H2O。
(2)氨气发生催化氧化生成NO和水,所以反应③的化学方程式为4NH3+5O2![]() 4NO+6H2O。氨气是碱性气体能使湿润的红色石蕊试纸变蓝色,所以可以用湿润的红色石蕊试纸检验氨气。
4NO+6H2O。氨气是碱性气体能使湿润的红色石蕊试纸变蓝色,所以可以用湿润的红色石蕊试纸检验氨气。
(3) Al元素在周期表中的位置是第三周期第ⅢA族。金属铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,因此②的离子方程式为2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑。
(4)过氧化钠溶于水即生成氢氧化钠和氧气,所以反应④的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。

【题目】关于强弱电解质及非电解质的组合完全正确的是( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | NaOH | HNO3 |
弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
非电解质 | Cl2 | CO2 | C2H5OH | SO2 |
A. A B. B C. C D. D





