题目内容
能源是人类社会生活和社会发展的基础.开发和利用清洁、高效的新能源已成为人类共同关注的重大课题.请阅读以下材料,回答有关问题:
(1)农村存在大量的秸秆、杂草等废弃物.它们经微生物发酵之后,便可产生沼气,可用来点火做饭或发电照明.在农村推广建造沼气池,不仅能有效地利用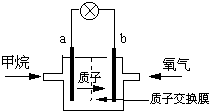
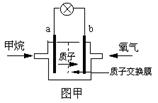
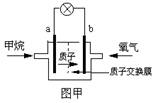
(2)某研究人员设计了如图所示的甲烷燃料电池.则该燃料电池的负极是
(1)农村存在大量的秸秆、杂草等废弃物.它们经微生物发酵之后,便可产生沼气,可用来点火做饭或发电照明.在农村推广建造沼气池,不仅能有效地利用
生物
生物
能,还能为农业生产提供优良的肥料.已知标准状况下11.2L甲烷完全燃烧生成液态水时放出445kJ的热量,请写出甲烷燃烧的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol
.
(2)某研究人员设计了如图所示的甲烷燃料电池.则该燃料电池的负极是
a
a
(填a或b),电极反应式为:CH4+2H2O-8e-═CO2+8H+
CH4+2H2O-8e-═CO2+8H+
每生成1mol水时转移的电子数:4NA
4NA
.分析:(1)秸秆、杂草等废弃物.它们经微生物发酵之后,便可产生沼气,可用来点火做饭或发电照明,说明是生物能转化为化学能;依据热化学方程式书写热化学方程式,标注物质聚集状态和对应反应的焓变;
(2)甲烷燃料电池,燃料做电池的负极发生氧化反应,依据化学方程式计算生成1mol水转移电子数;
(2)甲烷燃料电池,燃料做电池的负极发生氧化反应,依据化学方程式计算生成1mol水转移电子数;
解答:解:(1)秸秆、杂草等废弃物.它们经微生物发酵之后,便可产生沼气,可用来点火做饭或发电照明,说明是生物能转化为化学能;已知标准状况下11.2L甲烷物质的量为0.5mol,完全燃烧生成液态水时放出445kJ的热量,所以1mol甲烷烷醛燃烧生成二氧化碳和液态水放热890.0kJ,
甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
故答案为:生物能,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
(2)甲烷燃料电池,燃料做电池的负极发生氧化反应,反应的电极反应为:CH4+2H2O-8e-═CO2+8H+,依据化学方程式计算CH4(g)+2O2(g)═CO2(g)+2H2O(l),生成2mol水转移电子8mol,生成1mol水转移电子数4mol,即转移电子数4NA;
故答案为:4NA;
甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
故答案为:生物能,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol;
(2)甲烷燃料电池,燃料做电池的负极发生氧化反应,反应的电极反应为:CH4+2H2O-8e-═CO2+8H+,依据化学方程式计算CH4(g)+2O2(g)═CO2(g)+2H2O(l),生成2mol水转移电子8mol,生成1mol水转移电子数4mol,即转移电子数4NA;
故答案为:4NA;
点评:本题考查了热化学方程式的书写和计算应用,掌握书写原则是关键,题目较简单.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目