题目内容
能源是人类社会生活和社会发展的基础.请阅读以下材料,回答有关问题:
(1)在农村推广建造沼气池,不仅能有效地利用
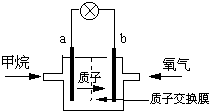
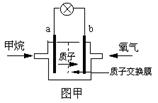
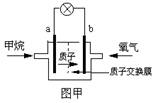
(2)某研究人员设计了如右图甲所示的甲烷燃料电池.则该燃料电池的负极是

(1)在农村推广建造沼气池,不仅能有效地利用
生物质
生物质
能,还能为农业生产提供优良的肥料.已知标准状况下11.2L甲烷完全燃烧生成液态水时放出445kJ的热量,请写出甲烷燃烧的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol
.(2)某研究人员设计了如右图甲所示的甲烷燃料电池.则该燃料电池的负极是
a
a
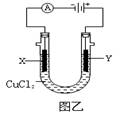
(填a或b).若以该电池为电源,石墨为电极电解CuCl2溶液(如右图乙所示),则Y极上发生的电极反应式为2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.若电解过程中共消耗标准状况下甲烷0.56L,则理论上可析出金属铜4.8
4.8
g(假设电解过程中总能量利用率为75%).
分析:(1)根据n=
计算甲烷的物质的量,进而计算1mol甲烷燃烧的反应热,即可写出反应的热化学方程式;
(2)甲烷燃料电池中,通入甲烷的一极为负极,发生氧化反应,在电解池中,阳极发生氧化反应,根据电极方程式和电子守恒计算析出铜的质量.
| V |
| Vm |
(2)甲烷燃料电池中,通入甲烷的一极为负极,发生氧化反应,在电解池中,阳极发生氧化反应,根据电极方程式和电子守恒计算析出铜的质量.
解答:解:(1)沼气的产生是在微生物的总用下生成的,利用的生物质能,
标准状况下11.2L甲烷的物质的量为
=0.5mol,
则1mol甲烷完全燃烧生成液态水放出的热量为:2×445kJ=890kJ,
所以甲烷燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890KJ/mol,
故答案为:生物质;CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890KJ/mol;
(2)甲烷燃料电池中,通入甲烷的一极为负极,发生氧化反应,
石墨为电极电解CuCl2溶液,Y极连接电源的正极,为电解池的阳极,发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,
若电解过程中共消耗标准状况下甲烷0.56L,则转移的电子的物质的量为
×8=0.2mol,
电解过程中总能量利用率为75%,则阴极上析出铜的物质的量为:
×0.2mol×75%=0.075mol,
理论上可析出金属铜的质量为:0.075mol×64g/mol=4.8g,故答案为:a;2Cl--2e-=Cl2↑;4.8.
标准状况下11.2L甲烷的物质的量为
| 11.2L |
| 22.4L/mol |
则1mol甲烷完全燃烧生成液态水放出的热量为:2×445kJ=890kJ,
所以甲烷燃烧的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890KJ/mol,
故答案为:生物质;CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890KJ/mol;
(2)甲烷燃料电池中,通入甲烷的一极为负极,发生氧化反应,
石墨为电极电解CuCl2溶液,Y极连接电源的正极,为电解池的阳极,发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,
若电解过程中共消耗标准状况下甲烷0.56L,则转移的电子的物质的量为
| 0.56L |
| 22.4L/mol |
电解过程中总能量利用率为75%,则阴极上析出铜的物质的量为:
| 1 |
| 2 |
理论上可析出金属铜的质量为:0.075mol×64g/mol=4.8g,故答案为:a;2Cl--2e-=Cl2↑;4.8.
点评:本题考查较为综合,涉及热化学方程式、原电池以及电解池等知识,题目难度中等,注意热化学方程式的书写方法以及原电池、电解池的工作原理.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目