题目内容
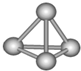 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如右图所示,
最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如右图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
分析:A、只由一种元素组成的纯净物为单质,由两种或两种以上的元素组成的纯净物为化合物,由此分析;
B、14N原子核内含有7个质子,质量数为14;
C、根据影响分子晶体的熔沸点高低的因素分析;
D、根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较.
B、14N原子核内含有7个质子,质量数为14;
C、根据影响分子晶体的熔沸点高低的因素分析;
D、根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较.
解答:解:A、N4是一种只由N元素组成的纯净物,为单质,故A错误;
B、14N原子核内含有7个质子,质量数为14,根据质量数=质子数+中子数,则中子数为7,故B错误;
C、N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,故C正确;
D、1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D错误.
故选C.
B、14N原子核内含有7个质子,质量数为14,根据质量数=质子数+中子数,则中子数为7,故B错误;
C、N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,故C正确;
D、1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故D错误.
故选C.
点评:本题考查较为综合,涉及物质的组成和分类、原子结构、晶体的性质以及反应热的计算等问题,题目难度不大,注意基础知识的把握.

练习册系列答案
相关题目
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )| A、N4属于一种新型的化合物 | B、N4沸点比P4(白磷)高 | C、N4分子存在非极性键 | D、1molN4气体转变为N2将吸收882kJ热量 |
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N键吸收167kJ热量,生成1molN≡N键放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN-N键吸收167kJ热量,生成1molN≡N键放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A、N4属于一种新型的化合物 | B、N4分子是非极性分子 | C、N4沸点比P4(白磷)高 | D、0.1molN4气体转变为N2将放出882kJ热量 |
 最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A、1 mol N4气体转变为N2将放出882 kJ热量 | B、N4分子中N为sp2杂化 | C、N4与N2互称为同位素 | D、N4沸点比P4(白磷)高 |
 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )