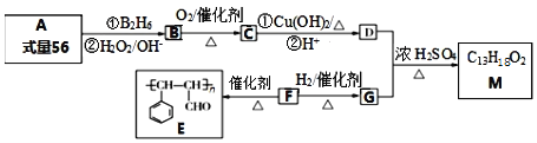
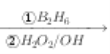题目内容
【题目】书写化学方程式:
(1)乙醛的银镜反应___________________
(2)1-溴丙烷的消去反应_______
(3)乙醇的催化氧化反应_______________________
(4)制取聚乙二酸乙二酯的反应方程式____________
【答案】CH3CHO+2[Ag(NH3)2]OH ![]() CH3COONH4+2Ag↓+3NH3+H2O CH3CH2CH2Br+NaOH
CH3COONH4+2Ag↓+3NH3+H2O CH3CH2CH2Br+NaOH ![]() CH3CH=CH2↑+NaBr+H2O 2CH3CH2OH+O2
CH3CH=CH2↑+NaBr+H2O 2CH3CH2OH+O2 ![]() 2 CH3CHO+2H2O n HOOCCOOH + n HOCH2CH2OH
2 CH3CHO+2H2O n HOOCCOOH + n HOCH2CH2OH ![]() HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O
HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O
【解析】
(1) 乙醛发生银镜反应是醛基的还原性被弱氧化剂氧化为乙酸,发生了氧化反应;
(2) 1-溴丙烷在NaOH醇溶液中发生消去反应生成丙烯;
(3)乙醇催化氧化生成乙醛;
(4) 乙二酸和乙二醇缩聚生成聚乙二酸乙二酯。
(1) 乙醛发生银镜反应是醛基的还原性被弱氧化剂氧化为乙酸,发生了氧化反应,反应的化学方程式为:CH3CHO+2[Ag(NH3)2]OH ![]() CH3COONH4+2Ag↓+3NH3+H2O ,
CH3COONH4+2Ag↓+3NH3+H2O ,
因此,本题正确答案是:CH3CHO+2[Ag(NH3)2]OH ![]() CH3COONH4+2Ag↓+3NH3+H2O ;
CH3COONH4+2Ag↓+3NH3+H2O ;
(2) 1-溴丙烷在NaOH醇溶液中发生消去反应生成丙烯,反应为CH3CH2CH2Br+NaOH![]() CH3CH=CH2↑+NaBr+H2O,
CH3CH=CH2↑+NaBr+H2O,
因此,本题正确答案是:CH3CH2CH2Br+NaOH ![]() CH3CH=CH2↑+NaBr+H2O;
CH3CH=CH2↑+NaBr+H2O;
(3)乙醇催化氧化生成乙醛,反应为2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,
2CH3CHO+2H2O,
因此,本题正确答案是:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(4) 乙二酸和乙二醇缩聚生成聚乙二酸乙二酯,反应为n HOOCCOOH + nHOCH2CH2OH ![]() HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O,
HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O,
因此,本题正确答案是:n HOOCCOOH + n HOCH2CH2OH ![]() HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O。
HO〔OCCOOCH2CH2O〕nH + (2n-1)H2O。