��Ŀ����
����Ŀ��ijͬѧͨ������װ�òⶨM��Ʒ��ֻ��![]() ��
��![]() ��
��![]() ���и��ɷֵ�����������ȡ����������Ϊ
���и��ɷֵ�����������ȡ����������Ϊ![]() ��M��Ʒ����ʵ��1����ͼ1����ʵ��2����ͼ2������ʵ�飬��ͬѧ˳�������ʵ�鲢�����������ֱ�Ϊ
��M��Ʒ����ʵ��1����ͼ1����ʵ��2����ͼ2������ʵ�飬��ͬѧ˳�������ʵ�鲢�����������ֱ�Ϊ![]() ��
��![]() �������㵽��״���£���
�������㵽��״���£���
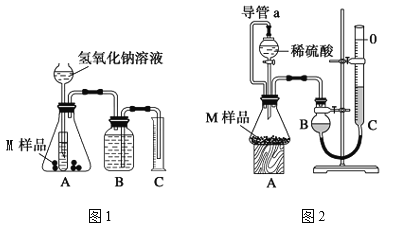
��1����ʵ��������ϡ��������98����Ũ����![]() ���Ƶģ����Ũ��������ʵ���Ũ����______
���Ƶģ����Ũ��������ʵ���Ũ����______![]() ��
��
��2��д��ʵ��1�п��ܷ�����Ӧ�����ӷ���ʽ��____________________________________��
��3������ʵ��2��ƽ�Ӷ���ǰӦ���ν��е����ֲ����ǣ���____________����____________��
��4��M��Ʒ��ͭ��������������ѧ����ʽΪ����![]() ��
��![]() ��ʾ����________________________��
��ʾ����________________________��
��5����ʵ����Ҫ![]() ��
��![]() ��Һ
��Һ![]() ����ش��������⣺
����ش��������⣺
������ʱӦ����______![]() ��
��
������![]() ��Һʱ��
��Һʱ��![]() �����к���
�����к���![]() ���ʻᵼ��������ҺŨ��______�����ƫ����ƫС������Ӱ�족����ͬ����
���ʻᵼ��������ҺŨ��______�����ƫ����ƫС������Ӱ�족����ͬ����
��6������ȥʵ��2�е���a��ʹ����������______��ʵ��1����ʵ��ǰ��Bƿ��ˮû��װ����ʹ����������______��
���𰸡�18.4 2Al+2OH��+2H2O=2AlO2��+3H2�� ��ȴ������ ����BCҺ����ƽ ![]() ��
��![]() 10.0 ƫ�� ƫ�� ��Ӱ��
10.0 ƫ�� ƫ�� ��Ӱ��
��������
�����⣬Mֻ����������ͭ���ֽ�����������������ǿ�ᷴӦ��������ǿ�Ӧ����ֻ������ǿ�ᣬ������ǿ�ͭ�Ȳ������������ƣ�Ҳ������ϡ������
��1������![]() �����Ũ��������ʵ���Ũ�ȣ�
�����Ũ��������ʵ���Ũ�ȣ�
��2��ʵ��1������������Һֻ������Ӧ��
��3������ʵ��2��ƽ�Ӷ���ǰӦ�ȵ���ȴ�����£��������ƶ�C�����ܣ�ʹB��CҺ����ƽ����Ŀ����ʹB���ռ�������ѹǿ����������ѹ���������õĶ�����ȷ��
��4������V1�ɼ������Ʒ�����������������������ᷴӦ�������������Ը���V2��V1��Ϊ�������ᷴӦ���ɵ������������������ٽ�һ������ͭ���������Ӷ������ͭ������������
��5����Ҫ����0.50molL��1��NaOH��Һ480mL����������ƿӦΪ500mL�����Լ����������Ƶ�����ʱҪ��500mL��Һ���㣻
��NaOH�����к���Na2O���ʣ���������ˮ�������Ϸ�Ӧ�����������ƣ�ʹ����Һ����������ƫ�࣬�ݴ˴��⣻
��6������ȥʵ��2�е���a������Һ��ʱ���ų���ƿ�в��ֿ��������²ⶨ���������ƫ�������ʵ��1ʵ��ǰBƿҺ��û��װ��ˮ����Ӱ��ʵ��������Ϊ������B���ռ������������������C����Һ��������
��1������![]() �ɵ�Ũ��������ʵ���Ũ��Ϊ
�ɵ�Ũ��������ʵ���Ũ��Ϊ![]() ��
��
��2��ʵ��1������������Һֻ������Ӧ����Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2����
��3������ʵ��2��ƽ�Ӷ���ǰӦ�ȵ���ȴ���������������ƶ�C�����ܣ�ʹB��CҺ����ƽ����Ŀ����ʹB���ռ�������ѹǿ����������ѹ���������õĶ�����ȷ��
��4������V1��������������Ƶķ�Ӧ��֪��Ʒ����������Ϊ![]() �������������ᷴӦ�������������Ը���V2-V1��Ϊ�������ᷴӦ���ɵ�������������Ʒ����������Ϊ
�������������ᷴӦ�������������Ը���V2-V1��Ϊ�������ᷴӦ���ɵ�������������Ʒ����������Ϊ![]() ��������Ʒ��ͭ�ĺ���Ϊ
��������Ʒ��ͭ�ĺ���Ϊ![]() =mg-
=mg-![]() ����ͭ�����������ı���ʽΪ��
����ͭ�����������ı���ʽΪ��![]() ��
��![]() ��
��
��5����Ҫ����0.50molL��1��NaOH��Һ480mL����������ƿӦΪ500mL����������ʱӦ����0.50molL��1��0.5L��40g/mol=10.0g NaOH��
��NaOH�����к���Na2O���ʣ���ͬ����ʱ����������ˮ��Ӧ���ɸ�����������ƣ�ʹ����Һ����������ƫ�࣬���Իᵼ��������ҺŨ��ƫ����
��6������ȥʵ��2����a������Һ��ʱ���ų���ƿ�в��ֿ��������²ⶨ���������ƫ�����ʵ��1ʵ��ǰBƿҺ��û��װ��ˮ����Ӱ��ʵ��������Ϊ������B���ռ������������������C����Һ��������

����Ŀ����1��ijͬѧΪ̽������KMnO4��Һ��H2C2O4�����ᣬ��Ԫ���ᣩ��Һ�ķ�Ӧ���̣���������ʵ�顣������������⣺
��д������KMnO4��Һ��H2C2O4�����ӷ���ʽ___________________________________��
������100mL0.0400mol��L-1��H2C2O4��Һ�����õ�������ƽ��ҩ�ס��ձ�����Ͳ���������������⣬�������õ��IJ���������_______________________________________��
�۽�KMnO4��Һ��ε���һ�����������H2C2O4��Һ�У��¶���ͬ����������¼���������£�
����KMnO4��Һ�Ĵ��� | KMnO4��Һ��ɫ��ȥ�����ʱ�� |
�ȵ����1�� | 60s |
��ɫ���ٵ����2�� | 15s |
��ɫ���ٵ����3�� | 3s |
��ɫ���ٵ����4�� | 1s |
�����KMnO4��Һ��ɫʱ��仯�Ŀ���ԭ��___________________________________��
��2��![]() ��
��![]() ����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L-1��Na2CrO4��Һ��
����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L-1��Na2CrO4��Һ��![]() ��c(H+)�ı仯��ͼ��ʾ
��c(H+)�ı仯��ͼ��ʾ

�������ӷ���ʽ��ʾ��Һ��![]() ��
��![]() ��ת����Ӧ_________��
��ת����Ӧ_________��
����ͼ��֪����Һ���Լ�С�� ![]() ��ƽ��ת����_________���������С�����䡱����
��ƽ��ת����_________���������С�����䡱����
�������¶ȣ���Һ��![]() ��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H_________0������ڡ���С�ڡ����ڡ�����
��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H_________0������ڡ���С�ڡ����ڡ�����









