题目内容
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32﹣、NO3﹣、Cl﹣、I﹣、SO42﹣中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( ) 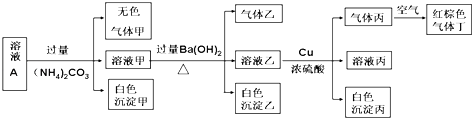
A.沉淀乙一定有BaCO3 , 可能有BaSO4
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.该溶液中一定有NO3﹣、Al3+、SO42﹣、Cl﹣四种离子
D.生成的甲、乙、丙气体均为无色的易溶于水气体
【答案】C
【解析】解:由溶液pH=1可知溶液为酸性溶液,氢离子浓度为0.1mol/L,溶液中一定不存在与氢离子反应的离子:CO32﹣、NO2﹣; 溶液A中加过量(NH4)2CO3 , 产生白色沉淀,可以排除Fe2+、Fe3+ , 原溶液中一定有Al3+;
溶液乙加铜和浓硫酸能产生NO,原溶液中有NO3﹣ , 强酸性溶液中有NO3﹣ , 则一定没有Fe2+、I﹣;
A.根据分析可知,溶液中含有硫酸根离子,所以沉淀乙中一定为碳酸钡和硫酸钡沉淀的化合物,故A错误;
B.根据反应方程式3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O可知,消耗14.4g铜,生成一氧化氮气体的物质的量为: ![]() =0.15mol,由于没有告诉是标准状况下,0.15mol一氧化氮的体积不一定为3.35L,故B错误;
=0.15mol,由于没有告诉是标准状况下,0.15mol一氧化氮的体积不一定为3.35L,故B错误;
C.根据以上分析可知,溶液中存在0.1mol/L的氢离子、0.1mol/L的铝离子,溶液中阳离子带有的电荷为:0.4mol/L;而溶液中除了存在0.1mol/L的硝酸根离子外,还应该含有SO42﹣离子和Cl﹣ , 所以该溶液中一定有NO3﹣、Al3+、SO42﹣、Cl﹣四种离子,故C正确;
D.产生的气体NO、CO2、NH3中,NO不溶于水,故D错误;
故选C.

 智能训练练测考系列答案
智能训练练测考系列答案【题目】如表是甲、乙、丙、丁四种有机物的有关信息;
甲 | ①能使溴的四氯化碳溶液褪色;②产量是衡量国家石油化工水平的重要标志; ③能与水在一定条件下反应生成丙 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与丁反应生成戊 |
丁 | ①由C、H、O三种元素组成;②球棍模型为 |
根据表中信息回答下列问题:
(1)写出实验室制备甲的化学方程式;
(2)乙与液溴反应的化学方程式为;
(3)丙与丁反应能生成戊,戊为相对分子质量为100的酯,该反应类型为 , 其化学反应方程式为;
(4)写出符合下列条件的戊的同分异构体的结构简式:;
I.分子中存在两个相同甲基并能使溴的四氯化碳溶液褪色
II.能与NaHCO3溶液发生反应.
