题目内容
【题目】γ-Fe2O3在磁性、催化、气敏等方面用途非常广泛,以硫铁矿烧渣(含Fe2O3、SiO2、CaO、Al2O3等)为原料生产γ-Fe2O3的流程如下:

(1)“还原焙烧”时,焦炭的作用是______________,起还原作用的主要物质是__________(填化学式)。
(2)“浸取”时,为提高铁的浸取率,可采取的措施除粉碎焙烧后的熔体、适当增大硫酸的用量外,还可采取的措施有______________(任写一条)。
(3)“过滤”前,将溶液的pH调至5~5.5的目的是将Al3+转化为___________(填化学式)。
(4)“缓慢干燥”生成铁黄的化学方程式为_____________。
(5)经上述流程制得的γ-Fe2O3中含有少量FeO和Al2O3杂质,某课题小组称取8.1380gγ-Fe2O3样品,溶于100mL2.00mol/LH2SO4溶液中,完全溶解后加入过量H2O2溶液,然后加入1.00mol/L的NaOH溶液,生成固体的质量与加入NaOH溶液体积的关系如图,则该样品中γ-Fe2O3的百分含量为___________(百分数保留到小数点后两位)。

【答案】
(1)燃烧提供热量和产生还原剂(2分);CO(1分)
(2)充分搅拌(或适当延长浸取时间等其他合理答案)(1分)
(3)Al(OH)3(1分)
(4)4Fe(OH)2+O2=4FeOOH+2H2O(2分)
(5)98.30%(2分)
【解析】
试题分析:(1)“还原焙烧”时,焦炭与氧气反应产生CO作还原剂,将三价铁转化为二价铁。所以焦炭的作用是燃烧提供热量和产生还原剂,起还原作用的主要物质是CO。
(2)“浸取”时,为提高铁的浸取率,可采取的措施除粉碎焙烧后的熔体、适当增大硫酸的用量外,还可以充分搅拌、适当延长浸取时间等。
(3)硫铁矿烧渣中含Fe2O3、SiO2、CaO、Al2O3等,应将SiO2、CaO、Al2O3等杂质处理除去,所以将溶液的pH调至5~5.5,目的是将Al3+转化为Al(OH)3。
(4)硫酸亚铁溶液加入氨水后转化为Fe(OH)2,在氧气作用下转化为铁黄FeOOH,所以“缓慢干燥”生成铁黄的化学方程式为4Fe(OH)2+O2=4FeOOH+2H2O。
(5)在样品中加入H2SO4溶液后发生的反应有Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O,FeO + H2SO4 = FeSO4 + H2O,Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O。再加入过量H2O2溶液将Fe2 + 氧化为Fe3 + 。由图像可知,O→A为NaOH中和过量的H2SO4,A→B为Al3+、Fe3+生成Al(OH)3、Fe(OH)3沉淀,B→C为Al(OH)3溶解。最后剩余的固体只有Fe(OH)3沉淀。B→C固体质量减少10.9095-10.7535=0.156g,即Al(OH)3为0.156g,为0.002mol,根据铝元素守恒,可得为Al2O3为0.001mol,质量为0.078g。最后剩余的固体只有Fe(OH)3沉淀,质量为10.7535g,为0.1005mol,即铁元素总物质的量为0.1005mol。100mL2.00mol/LH2SO4为0.2mol,与0.001molAl2O3反应用掉0.003mol,与93mL1.00mol/L的NaOH反应用掉0.0465mol,则与FeO和Fe2O3反应共用H2SO4为0.2mol-0.003mol-0.0465mol=0.1505mol。设Fe2O3为amol,则FeO为(0.1005-2a)mol,根据反应方程式可得3a+(0.1005-2a)=0.1505。求解可得a=0.05mol。则该样品中γ-Fe2O3的百分含量为![]() =98.30%。
=98.30%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
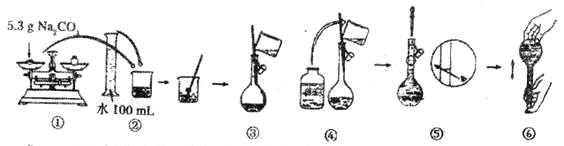
小学生10分钟应用题系列答案【题目】

(1)该硫酸的物质的量浓度是________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要490 mL 4.6 mol/L的稀硫酸,则需要取________mL的该硫酸。
(3)配制时,所需的玻璃仪器除量筒、烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);
(4)配制溶液有如下(未按顺序排列):a.溶解,b.摇匀,c.洗涤,d.冷却,e.称量,f.将溶液移至容量瓶,g.定容等操作。其中摇匀的前一步操作是 ;(填写字母)
(5)在下列配制过程示意图中,有错误的是(填写序号) 。
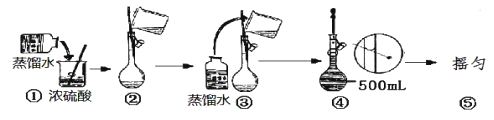
(6)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是
A.未经冷却趁热将溶液注入容量瓶中 | B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 | D.未洗涤烧杯和玻璃棒 |