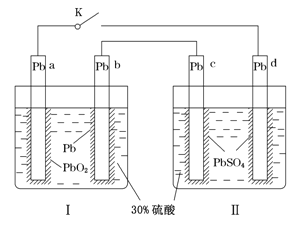
题目内容
【题目】硫和氮及其化合物在生产生活中应用广泛。请回答:
(1)已知反应:3NO2+H2O=2HNO3+NO,该反应中的氧化剂与还原剂的质量比为_____。
(2)工业上可以通过氮气和氢气在一定条件下合成氨气。下列关于氨气的性质和用途描述正确的是____________。
A. 氨气易液化,液氨可作制冷剂 B. 可用排水法收集氨气
C. 氨气是一种无色无味的气体 D. 向氨水中滴加酚酞,溶液变红
(3)1754年,Briestly用硵砂(主要成份NH4Cl)和熟石灰共热制得了氨,化学反应方程式为______________________________。
(4)实验室用金属铜和稀硝酸制取NO的离子方程式为_____________。
(5)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
(6)19.2 g铜投入100 mL 14 mol/L浓HNO3溶液中,充分反应后无固体剩余,收集到标准状况下气体8.96 L(气体为NO、NO2),向反应后的溶液中加入______mL 10 mol/L NaOH溶液才能使Cu2+完全沉淀。
【答案】1∶2 AD Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O 2CO+2NO
CaCl2+2NH3↑+2H2O 3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O 2CO+2NO![]() N2+2CO2 100
N2+2CO2 100
【解析】
(1)根据还原剂失去电子,元素化合价升高;氧化剂得到电子,元素化合价降低分析;
(2)根据氨气的性质分析判断;
(3) NH4Cl和熟石灰混合加热发生复分解反应制取氨气;
(4)铜和稀硝酸反应产生硝酸铜、NO、水,根据离子方程式书写原则书写;
(5)CO和NO反应产生N2、CO2,据此书写反应方程式;
(6)利用元素守恒,反应后溶液的溶质为NaNO3,HNO3最终变为NaNO3和NO、NO2气体,根据Na元素守恒计算加入NaOH的物质的量,再根据c=![]() 计算NaOH的体积。
计算NaOH的体积。
(1)在反应3NO2+H2O=2HNO3+NO中,只有N元素的化合价发生变化,反应前NO2中的N为+4价,反应后一部分变为HNO3中的+5价,化合价升高,失去电子,被氧化,NO2作还原剂;一部分变为NO中的+2价,化合价降低,得到电子,被还原,NO2作氧化剂。3个NO2反应,有1个作氧化剂,2个作还原剂,所以该反应中的氧化剂与还原剂的质量比为1:2;
(2) A. 氨气沸点高,易液化,液氨气化吸收大量的热,使周围环境温度降低,因此液氨可作制冷剂,A正确;
B. 氨气极容易溶于水,因此不能用排水法收集氨气,B错误;
C. 氨气是一种无色有刺激性气味的气体,C错误;
D. 氨气溶于水,与水反应产生一水合氨,一水合氨电离产生OH-,使溶液显弱碱性,因此向氨水中滴加酚酞,溶液会变红色,D正确;
故合理选项是AD;
(3)在实验室中一般是用铵盐NH4Cl和熟石灰混合加热发生复分解反应制取氨气,反应方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)铜和稀硝酸反应产生硝酸铜、NO、水,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2+ +2NO↑+4H2O;
(5)CO和NO在催化剂存在时发生氧化还原反应产生N2、CO2,根据电子守恒、原子守恒,可得反应方程式为:2CO+2NO![]() N2+2CO2;
N2+2CO2;
(6)100 mL14 mol/L浓HNO3溶液中n(HNO3)=c·V=14 mol/L×0.1 L=1.4 mol,硝酸与Cu反应变为Cu(NO3)2、NO、NO2,产生NO、NO2的物质的量为n(NO+NO2)=![]() =0.4 mol,向反应后的溶液中加入NaOH,当Cu2+恰好形成Cu(OH)2沉淀时,溶液中的溶质为NaNO3则根据N元素守恒可知NaNO3的物质的量为n(NaNO3)=1.4 mol-0.4 mol=1.0 mol,根据Na、N元素之间关系可知n(NaOH)=n (NaNO3)=1.0 mol,所以需加入10 mol/L NaOH溶液的体积V(NaOH)=
=0.4 mol,向反应后的溶液中加入NaOH,当Cu2+恰好形成Cu(OH)2沉淀时,溶液中的溶质为NaNO3则根据N元素守恒可知NaNO3的物质的量为n(NaNO3)=1.4 mol-0.4 mol=1.0 mol,根据Na、N元素之间关系可知n(NaOH)=n (NaNO3)=1.0 mol,所以需加入10 mol/L NaOH溶液的体积V(NaOH)=![]() =0.1 L=100 mL。
=0.1 L=100 mL。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
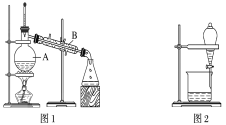
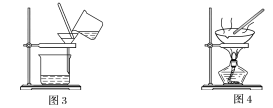
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ||||||
第三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
第四周期 | ⑧ | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_________(填元素符号)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是:_________,碱性最强的化合物的电子式是:_________。
(3)元素⑤的单质与元素③的最高价氧化物对应的水化物反应的离子方程式为_________。
(4)元素②的简单氢化物是由_________ (填“极性”或“非极性”)键形成的,在常温下该化合物与元素⑥的单质反应的离方程式为__________________。
(5)元素②、③、⑥、⑧四种元素形成的离子,离子半径由大到小的顺序是_________ (用离子符号表示)。