题目内容
4. 某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E. 旋开活塞,用烧杯接收溶液;
F. 从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
(1)萃取过程正确操作步骤的顺序是:(填编号字母)CBDAHGEF.
(2)设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:取少量(或1~2mL)该水溶液于试管中,加入淀粉溶液,若变蓝,则该水溶液中还含有单质碘.
(3)最后碘的CCl4是通过漏斗下口获得(填“漏斗上口”或“漏斗下口”).从含碘的CCl4溶液中提取碘和回收CCl4,还需要经过蒸馏,观察如图所示实验装置指出其错误有5处.
(4)进行上述蒸馏操作时,最后晶态碘在蒸馏烧瓶(填仪器名称)里聚集.
分析 (1)萃取分液实验的一般步骤:操作为查漏→装液→振荡→静置→分液,据此解答;
(2)依据单质碘遇到淀粉能够变蓝的性质解答;
(3)依据分液的正确操作及蒸馏实验原理和装置解答;
(4)依据碘的沸点高于四氯化碳解答.
解答 解:(1)CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,操作为查漏→装液→振荡→静置→分液,则正确的顺序为:C→B→D→A→H→G→E→F,
故答案为:CBDAHGEF;
(2)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘),
故答案为:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘);
(3)CCl4从碘水中萃取碘静置分液后,上层液体从上口倒出,下层液体从下口流出,四氯化碳密度大于水,所以四氯化碳层应从分液漏斗下口流出;
从含碘的CCl4溶液中提取碘和回收CCl4,还需要经过蒸馏,蒸馏时应加入碎瓷片反正爆沸;温度计水银球应放在蒸馏烧瓶支管口处;冷凝水应从下口进入上口流出;尾接管与锥形瓶之间有塞子;烧杯加热应垫上石棉网;
所以共5处错误;
故答案为:漏斗下口; 5;
(4)碘的沸点为184℃,比四氯化碳沸点高,所以最后晶态碘在蒸馏烧瓶里聚集;
故答案为:蒸馏烧瓶.
点评 本题考查了常见的物质分离方法,明确萃取分液、蒸馏实验的原理是解题关键,注意蒸馏实验中温度计位置、冷凝水方向,题目难度不大.

练习册系列答案
相关题目
14.同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )
| A. | 体积比 1:1 | B. | 体积比 11:16 | ||
| C. | 物质的量比 16:11 | D. | 密度比 11:16 |
15.下列变化属于吸热过程的是( )
| A. | 天然气燃烧 | B. | 浓硫酸溶于水 | ||
| C. | CaO与水反应 | D. | B a(OH)2晶体与NH4Cl反应 |
12.下列有关强、弱电解质的叙述正确的是( )
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在1L 0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA | |
| B. | 常温常压下,Na202与足量H20反应,生成4.48L 02,转移电子的数目为0.2NA | |
| C. | 在密闭容器中充人1.5 mol H2和0.5 mol N2,充分反应后可得到NH3的分子数为NA | |
| D. | 电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g |
14.下列图象表达正确的是( )
| A. |  表示25℃时,用0.1mol•L-1盐酸滴定20mL 0.1mol•L-1氨水 | |
| B. | 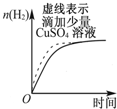 表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 | |
| C. |  表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | |
| D. |  表示向盐酸溶液中滴入氨水 |
 (1)把3molA和2.5molB混合,充入2L密闭容器中,发生下列反应:3A(g)+B(g)═xC(g)+2D(g)经5秒钟反应达到平衡,生成1molD,并测得C的平均反应速率为0.1mol•L-1•s-1,则此反应中B的转化率为20%,C的化学计量数x为2,A的平衡浓度为0.75mol/L.
(1)把3molA和2.5molB混合,充入2L密闭容器中,发生下列反应:3A(g)+B(g)═xC(g)+2D(g)经5秒钟反应达到平衡,生成1molD,并测得C的平均反应速率为0.1mol•L-1•s-1,则此反应中B的转化率为20%,C的化学计量数x为2,A的平衡浓度为0.75mol/L.