题目内容
16.已知下热化学方程式:①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
③2C(s)+O2 (g)═2CO (g)△H=-221kJ/mol
④C(s)+O2 (g)═CO2(g)△H=-393.5kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是①②③④.(填序号)
(2)H2的燃烧热为285.8kJ/mol.
(3)燃烧0.1g H2(g)生成液态水,放出的热量为14.29KJ.
(4)CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol.
分析 (1)根据反应的焓变大于零,是吸热反应,反之为放热反应,据此解答;
(2)燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,据此解答;
(3)根据热化学方程式利用热量和物质的质量关系求解;
(4)利用盖斯定律:④-③×$\frac{1}{2}$求解.
解答 解:(1)根据热化学反映方程式的定义知:△H<0为放热反应所以放热反应的为:①②③④,故答案为:①②③④;
(2)根据燃烧热的定义,1molH2完全燃烧生成稳定液态水放出的热量为H2的燃烧热,所以由①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol得出,H2的燃烧热为285.8 kJ/mol;故答案为:285.8 kJ/mol;
(3)由2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则燃烧0.1g H2(g)生成液态水,放出的热量为$\frac{571.6}{4}$×0.1=14.29KJ,故答案为:14.29KJ;
(4)1molCO完全燃烧生成稳定CO2 放出的热量为CO的燃烧热,
由③2C(s)+O2 (g)═2CO (g)△H=-221kJ/mol
④C(s)+O2 (g)═CO2(g)△H=-393.5kJ/mol
可知:④-③×$\frac{1}{2}$可得:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol.
点评 本题主要考查了化学反应中能量的计算,根据热化学方程式的意义和盖斯定律即可完成,题目难度中等.

练习册系列答案
相关题目
6.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与稀硫酸的反应 OH-+H+═H2O | |
| B. | 氧化钙与稀盐酸反应 CaO+2H+═Ca2++H2O | |
| C. | 铁片插入硝酸银溶液中 Fe+Ag+═Fe2++Ag | |
| D. | 碳酸钙溶于稀硝酸中 CO32-+2H+═CO2↑+H2O |
7.下列工业生产的主要反应中,涉及置换反应的是( )
| A. | 生产粗硅 | B. | 海水提镁 | C. | 电解冶铝 | D. | 生产硫酸 |
11.高效能电池的研发制约电动汽车的推广.有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,有关此电池的推断正确的是( )
| A. | 负极反应为:14H2O+7O2+28e-═28OH- | |
| B. | 放电过程中KOH的物质的量浓度不变 | |
| C. | 每消耗1 mol C2H6,则电路上转移的电子为14 mol | |
| D. | 放电一段时间后,负极周围的碱性增强 |
1.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去产物只有1种 的消去产物只有1种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
8.下列有关说法或表示正确的是( )
| A. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| B. |  既可表示18O2-,也可以表示16O2- 既可表示18O2-,也可以表示16O2- | |
| C. | Fe-2e-═Fe2+可表示钢铁析氢腐蚀和吸氧腐蚀的正极反应 | |
| D. | 乙醇分子的比例模型: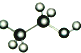 |
5.下列对于某些离子(或物质)的检验及结论一定正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,不一定有Ba2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸后再加入硝酸银,产生白色沉淀,则原溶液一定有Cl- | |
| D. | 加入稀盐酸产生无色气体,原物质一定有CO32- |
6.将A与B的混合气体1mol放入容积为2L的密闭容器内,在一定条件下发生反应:2A(g)+3B(g)?C(g)+2D(g),经过4min达到平衡,此时容器内的压强是反应前的3/5,以各气体的浓度变化表示的反应速率正确的是( )
| A. | vA=0.005 mol•(L•min)-1 | B. | vC=0.025mol•(L•min)-1 | ||
| C. | vB=0.150mol•(L•min)-1 | D. | vD=0.015mol•(L•min)-1 |
 某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步: