题目内容
【题目】已知A、B、C、D、E、F为元素周期表中前四周期且原子序数依次增大的六种元素.其中A、B、C、D核电荷数之和为36,A、C原子的最外层电子数之和等于B原子 的次外层电子数,D原子质子数为B原子质子数的两倍,E元素所在主族均为金属,F的价电子数与C的核电荷数相等。
(1)下列关于上述几种元素的说法正确的是_________。
a.B、C、D的原子半径由大到小的顺序为:D >C >B
b.E、F的最外层电子数相等
c.A、B、C、D四种元素中电负性和第一电离能最大的均为B
d.B与C形成的化合物中可能含有非极性键
e.A、C、F都位于周期表的3区
(2)B单质有两种同素异形体.其中在水中溶解度较大的是_______(填化学式)。
(3)EA2和A2B熔点较高的是 _______(填化学式),原因是_________。
(4)D与B可以形成两种分子,其中DB2分子中心原子的杂化类型是____。下列分子或离子中与DB3结构相似的是____________。
a. NH3 b. SO32- c.NO3- d.PCl3
(5)已知B、F能形成两种化合物,其晶胞如下图所示.则高温时甲易转化为乙的原因为 ___________。若乙晶体密度为pg/cm3,则乙晶胞的晶胞边长a =________nm(用含P和NA的式子表示)

【答案】 cd O3 CaH2 CaH2属于离子晶体,H2O属于分子晶体 sp2 c CuO中Cu2+外围电子排布为3d9,而Cu2O中Cu+外围电子排布为3d10,属于稳定结构 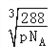 ×107 nm.
×107 nm.
【解析】A、B、C、D、E、F为元素周期表中前四周期且原子序数依次增大的六种元素,A、B、C、D核电荷数之和为36,则B不能位于第三周期,由于第三周期中Na、Mg、Al三者原子序数之和最小为36,A、C原子的最外层电子数之和等于B原子的次外层电子数,则B处于第二周期,A、C原子最外层电子数均为1,二者处于IA族,C、D不可能处于第三周期,因为第四周期中K、Ca二者原子序数之和最小为39,故C也属于短周期元素,C的原子序数又大于B,故C为Na,A为氢或锂,A、B、D原子序数之和为36-11=25,D原子质子数为B原子质子的两倍,则A为H元素、B为O元素、D为S元素;E元素所在主族均为金属,则E处于ⅡA族,原子序数大于硫,故E为Ca。F的价电子数与C的核电荷数相等,F的原子序数最大,因此F是Cu;
(1)a.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:C(Na)>D(S)>B(O),a错误;b.E为Ca、F为Cu,二者最外层电子数分别为2、1,b错误;c.H、O、Na、S四种元素中电负性和第一电离能最大的均为O,c正确;d.B与C形成的化合物为氧化钠、过氧化钠,过氧化钠中含有非极性键,d正确;e.H、Na位于周期表的s区,Cu处于周期表中ds区,e错误,答案选cd;(2)B单质有两种同素异形体有氧气、臭氧,O2分子为非极性分子,而O3分子为极性分子,水分子是极性分子,相似相溶,故在水中溶解度较大的是O3;(3)CaH2属于离子晶体,H2O属于分子晶体,熔点较高的是CaH2;(4)SO2分子中S原子孤电子对数=(62×2)/2=1,价层电子对数=2+1=3,故S原子的杂化类型是 sp2,SO3中S原子孤电子对数=(62×3)/2=0,价层电子对数为3+3=3,为平面三角形结构,NH3为三角锥形结构,SO32-中S原子孤电子对数=(6+22×3)/2=1,价层电子对数=3+1=4,为三角锥形结构,NO3- 中N原子孤电子对数=(5+12×3)/2=0,价层电子对数=3+0=3,为平面三角形结构,PCl3为三角锥形结构;(5)甲中Cu原子数目为4,氧原子数目为8×1/8+6×1/2=4,化学式为CuO,乙中Cu原子数目为4,氧原子数目为1+8×1/8=2,化学式为Cu2O,Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,属于稳定结构,故高温下CuO可以转化为Cu2O,乙晶体密度为pg/cm3,乙晶胞质量为2×144/NAg,则晶胞参数=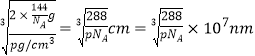 。
。






