题目内容
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.常温常压下,E单质是淡黄色固体,常在火山口附近沉积.
(1)B、C两种元素的元素符号:B: ; C: .D在元素周期表中的位置为 .
(2)A2E的燃烧热△H=-a kJ?mol-1,写出A2E燃烧反应的热化学方程式: .
(3)CA的电子式为 ;CA与水反应放出气体的化学方程式为 .
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同.回答问题:
①向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式 , .
②向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为 .
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式: ;由R生成Q的化学方程式: .
(1)B、C两种元素的元素符号:B:
(2)A2E的燃烧热△H=-a kJ?mol-1,写出A2E燃烧反应的热化学方程式:
(3)CA的电子式为
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同.回答问题:
①向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式
②向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式:
分析:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,E为S元素,据此解答.
解答:解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,E为S元素,
(1)由上述分析可知,B为C元素、C为Na元素;D为Al元素,处于第三周期第ⅢA族,故答案为:C;Na;第三周期第ⅢA族;
(2)H2S的燃烧热△H=-a kJ?mol-1,则H2S燃烧反应的热化学方程式为:H2S (g)+
O2(g)=SO2 (g)+H2O (l)△H=-a kJ?mol-1,
故答案为:H2S (g)+
O2(g)=SO2 (g)+H2O (l)△H=-a kJ?mol-1;
(3)NaH属于离子化合物,其电子式为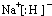 ;NaH与水发生水解反应,生成NaOH与氢气,化学方程式为NaH+H2O=NaOH+H2↑,
;NaH与水发生水解反应,生成NaOH与氢气,化学方程式为NaH+H2O=NaOH+H2↑,
故答案为: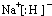 ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同,则甲为Na2CO3,乙为NaAlO2,丙为NaHSO4,
①向NaHSO4溶液中缓慢滴加过量的NaAlO2溶液,过程中发生反应的离子方程式:4H++AlO2-═Al3++2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:4H++AlO2-═Al3++2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓;
②向Na2CO3溶液中缓慢滴加等物质的量的NaHSO4溶液,二者恰好反应,所得溶液为NaHCO3、Na2SO4等浓度混合溶液,HCO3-水解大于其电离程度,溶液呈碱性,故C(OH-)>C(H+),且水也电离产生H+,溶液中C(H+)>C(CO32-),水解程度比较小,故溶液中C(Na+)>C(SO42-)>C(HCO3-)>C(OH-)>C(H+)>C(CO32-),
故答案为:C(Na+)>C(SO42-)>C(HCO3-)>C(OH-)>C(H+)>C(CO32-);
(5)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,阳极发生反应:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑,生成难溶物R为Al(OH)3,Al(OH)3受热分解生成化合物氧化铝,反应方程式为:2Al(OH)3
Al2O3+3H2O,
故答案为:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑;2Al(OH)3
Al2O3+3H2O.
(1)由上述分析可知,B为C元素、C为Na元素;D为Al元素,处于第三周期第ⅢA族,故答案为:C;Na;第三周期第ⅢA族;
(2)H2S的燃烧热△H=-a kJ?mol-1,则H2S燃烧反应的热化学方程式为:H2S (g)+
| 3 |
| 2 |
故答案为:H2S (g)+
| 3 |
| 2 |
(3)NaH属于离子化合物,其电子式为
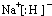 ;NaH与水发生水解反应,生成NaOH与氢气,化学方程式为NaH+H2O=NaOH+H2↑,
;NaH与水发生水解反应,生成NaOH与氢气,化学方程式为NaH+H2O=NaOH+H2↑,故答案为:
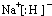 ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同,则甲为Na2CO3,乙为NaAlO2,丙为NaHSO4,
①向NaHSO4溶液中缓慢滴加过量的NaAlO2溶液,过程中发生反应的离子方程式:4H++AlO2-═Al3++2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:4H++AlO2-═Al3++2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓;
②向Na2CO3溶液中缓慢滴加等物质的量的NaHSO4溶液,二者恰好反应,所得溶液为NaHCO3、Na2SO4等浓度混合溶液,HCO3-水解大于其电离程度,溶液呈碱性,故C(OH-)>C(H+),且水也电离产生H+,溶液中C(H+)>C(CO32-),水解程度比较小,故溶液中C(Na+)>C(SO42-)>C(HCO3-)>C(OH-)>C(H+)>C(CO32-),
故答案为:C(Na+)>C(SO42-)>C(HCO3-)>C(OH-)>C(H+)>C(CO32-);
(5)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,阳极发生反应:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑,生成难溶物R为Al(OH)3,Al(OH)3受热分解生成化合物氧化铝,反应方程式为:2Al(OH)3
| ||
故答案为:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑;2Al(OH)3
| ||
点评:本题考查结构性质位置关系应用综合应用,涉及元素化合物推断、热化学方程式、电子式、离子浓度比较、原电池等,题目综合性较大,推断元素是解题关键,(5)中阳极反应式可以一步书写,难度中等,注意对基础知识的全面掌握.

练习册系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: