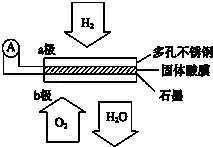
题目内容
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题: 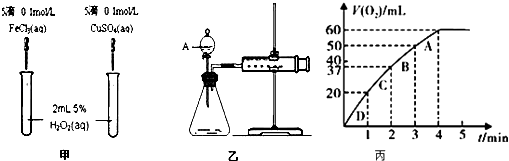
(1)定性分析:如图甲可通过观察现象,定性比较得出结论.有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为 , 实验中需要测量的数据是 .
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示. ①实验时放出气体的总体积是mL.
②A、B、C、D各点反应速率快慢的顺序为>>> .
③解释反应速率变化的原因 .
【答案】
(1)反应产生气泡快慢;消除阴离子不同对实验的干扰
(2)分液漏斗;产生40mL气体所需的时间
(3)60;D;C;B;A;随着反应的进行,浓度减小,反应速率减慢
【解析】解:(1)该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢或反应完成的先后或试管壁的冷热程度来判断;H2O2分解的催化作用有可能是阴离子起的作用,改为CuCl2使阴离子相同,这样可以消除阴离子不同对实验的干扰,更为合理, 所以答案是:反应产生气泡快慢;消除阴离子不同对实验的干扰;(2)A是分液漏斗;收集的气体的体积相同,若比较反应速率快慢,需要知道生成40mL气体所需的时间,
所以答案是:分液漏斗;产生40mL气体所需的时间;(3)①根据图像知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60mL,
所以答案是:60; ②根据图像结合v= ![]() 知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,
知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,
所以答案是:D;C;B;A;③原因:反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
所以答案是:随着反应的进行,浓度减小,反应速率减慢.

【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是 .
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 .
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(3)已知高碘酸有两种形式,化学式分别为H5IO6(结构如上图)和HIO4 , 前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6HIO4 . (填“>”、“<”或“=”)
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I﹣+I2=I3﹣ . I3﹣离子的中心原子周围σ键电子对对数为 . 与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列式发生.
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知CaF2晶体的密度为ρg/cm3 , NA为阿伏加德罗常数,CaF2晶胞的边长为a pm,则CaF2的相对分子质量可以表示为(用含a的式子表示).