题目内容
实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图4-3所示: 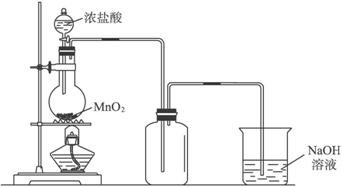
图4-3
(1)圆底烧瓶中发生反应的离子方程式:_______________________________________。
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有:
①_________________________________________________________________,
②_________________________________________________________________。
(3)为了提高浓盐酸的利用率,你对实验的建议是_____________________________________。
(4)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是_____________,有关的离子方程式是_____________________________。
解析:(1)由制取Cl2的化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,可知离子方程式为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,可知离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)当20 mL 12 mol·L-1的盐酸完全反应产生氯气为0.06 mol,由于盐酸受热易挥发,且随着反应的不断进行,盐酸浓度越来越小,变为稀盐酸后不再与MnO2反应,所以产生氯气的物质的量小于0.06 mol。
(3)针对(2)中分析氯气减少的原因,可采取将浓盐酸慢慢滴入,用小火加热等措施,提高浓盐酸的利用率。
(4)选用碱液如NaOH溶液来吸收多余的氯气。
答案:(1)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)加热使HCl大量挥发 盐酸变稀后不再发生反应
(3)将浓盐酸慢慢滴下;加热时用小火慢慢加热
(4)NaOH溶液 Cl2+2OH-====Cl-+ClO-+H2O

 Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0