��Ŀ����
 ��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��
��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0��1�����д�ʩ����ʹƽ��ʱ
| c(CO) | c(CO2) |
B
B
������ţ���A������ѹǿ B�������¶� C������һ�������� D���ټ���һЩ����
��2����Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2����CO2��ת���ʽ�
����
����
�����������С���������䡱������3��������Ҫ������������������Ӧ��ʮ�ֹ㷺���������ƣ�Na2FeO4����һ����������ˮ��������
�ٸ���������������֮һ����ǿ������Һ����NaClO����Fe��OH��3���ɸ������ơ��Ȼ��ƺ���һ�ֳ���������ֲ�����66.4g�������ƣ�ת�Ƶ�����ĿΪ
1.2NA��1.2��6.02��1023
1.2NA��1.2��6.02��1023
���ڸ���������������֮����ⷨ���ø�Ĥʽ���ۣ���Ũ����Һ�У�������⣬��Fe�����ɸ������Σ�ʵ�����п�����ͼ��ʾװ�ý���ʵ�飮д�������ĵ缫��Ӧʽ
Fe+8OH--6e-=FeO42-+4H2O
Fe+8OH--6e-=FeO42-+4H2O
��������һ����Ҫ�Ļ���ԭ�ϣ��������ǹ�ҵ�����������Ҫԭ�ϣ�
��1���ݱ�����Mg��ʯī���缫��NH4Cl��Һ�γ�ԭ��أ�Ҳ������NH3���䷴Ӧ��Mg+2NH4Cl=MgCl2+2NH3��+H2����д���õ�������ĵ缫��Ӧʽ
2NH4++2e-=2NH3��+H2��
2NH4++2e-=2NH3��+H2��
����2�����᳧���ü�Һ���շ�����β������Na2CO3��Һ����NO2����CO2����ÿ2mol NO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol����Ӧ�����ӷ���ʽ��
2NO2+CO32-=NO3-+NO2-+CO2
2NO2+CO32-=NO3-+NO2-+CO2
����������1��Ҫʹƽ��ʱ
����Ӧʹƽ��������Ӧ�����ƶ���
��2�����ݷ�Ӧǰ������ļ�����֮���Լ�ѹǿ��ƽ���ƶ���Ӱ�������
��3���ٸ�������������ʵ����ͻ��ϼ۵ı仯���㷴Ӧת�Ƶĵ�������
����������������Ӧ�����ݷ�Ӧ�����������д�缫��Ӧʽ��
��1�������ܷ�Ӧʽ������������ԭ��Ӧ���ص���д�缫��Ӧʽ��
��2�����ݻ��ϼ۵ı仯�ж�������Դ���д��Ӧ�����ӷ���ʽ��
| c(CO) |
| c(CO2) |
��2�����ݷ�Ӧǰ������ļ�����֮���Լ�ѹǿ��ƽ���ƶ���Ӱ�������
��3���ٸ�������������ʵ����ͻ��ϼ۵ı仯���㷴Ӧת�Ƶĵ�������
����������������Ӧ�����ݷ�Ӧ�����������д�缫��Ӧʽ��
��1�������ܷ�Ӧʽ������������ԭ��Ӧ���ص���д�缫��Ӧʽ��
��2�����ݻ��ϼ۵ı仯�ж�������Դ���д��Ӧ�����ӷ���ʽ��
����⣺��1��A������ѹǿ��ƽ�ⲻ�ƶ���
���䣬��A����
B����ӦΪ���ȹ��̣������¶�ƽ��������Ӧ�����ƶ���
����B��ȷ��
C������һ����������ƽ��û��Ӱ�죬
���䣬��C����
D������Է�Ӧ���ʼ���ѧƽ���ƶ�û��Ӱ�죬
���䣬��D����
�ʴ�Ϊ��B��
��2���ڸ÷�Ӧ�У�����Ļ�ѧ������֮�ͷ�Ӧǰ����ȣ�ѹǿ��ƽ���ƶ�û��Ӱ�죬��Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2���൱����ԭ���Ļ�������С���������ѹǿ��ƽ�ⲻ�ƶ������������������������ʱ����ͨ��һ������CO2���ﵽƽ��ʱCO2��ת���ʲ��䣬�ʴ�Ϊ�����䣻
��3����n��Na2FeO4��=
=0.4mol������Fe��OH��3��Na2FeO4��
��֪ת�Ƶ�����ĿΪ0.4mol��3��NA/mol=1.2 NA��1.2��6.02��1023��
�ʴ�Ϊ��1.2 NA��1.2��6.02��1023��
�ڵ��ʱFe��������ʧȥ��������FeO42-����缫��ӦʽӦΪFe+8OH--6e-=FeO42-+4H2O��
�ʴ�Ϊ��Fe+8OH--6e-=FeO42-+4H2O��
��1����Ӧ���ܷ�ӦʽΪMg+2NH4Cl=MgCl2+2NH3��+H2������2NH4+�������ϵõ�������NH3��H2��������ԭ��Ӧ�缫��ӦʽΪ2NH4++2e-=2NH3��+H2����
�ʴ�Ϊ��2NH4++2e-=2NH3��+H2����
��2��ÿ2molNO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ��ڼ�����Һ��Ӧ����NO3-��NO2-����Ӧ�����ӷ���ʽΪ2NO2+CO32-=NO3-+NO2-+CO2��
�ʴ�Ϊ��2NO2+CO32-=NO3-+NO2-+CO2��
| c(CO) |
| c(CO2) |
B����ӦΪ���ȹ��̣������¶�ƽ��������Ӧ�����ƶ���
| c(CO) |
| c(CO2) |
C������һ����������ƽ��û��Ӱ�죬
| c(CO) |
| c(CO2) |
D������Է�Ӧ���ʼ���ѧƽ���ƶ�û��Ӱ�죬
| c(CO) |
| c(CO2) |
�ʴ�Ϊ��B��
��2���ڸ÷�Ӧ�У�����Ļ�ѧ������֮�ͷ�Ӧǰ����ȣ�ѹǿ��ƽ���ƶ�û��Ӱ�죬��Ӧ�ﵽƽ��������������������ʱ����ͨ��һ������CO2���൱����ԭ���Ļ�������С���������ѹǿ��ƽ�ⲻ�ƶ������������������������ʱ����ͨ��һ������CO2���ﵽƽ��ʱCO2��ת���ʲ��䣬�ʴ�Ϊ�����䣻
��3����n��Na2FeO4��=
| 66.4g |
| 166g/mol |
��֪ת�Ƶ�����ĿΪ0.4mol��3��NA/mol=1.2 NA��1.2��6.02��1023��
�ʴ�Ϊ��1.2 NA��1.2��6.02��1023��
�ڵ��ʱFe��������ʧȥ��������FeO42-����缫��ӦʽӦΪFe+8OH--6e-=FeO42-+4H2O��
�ʴ�Ϊ��Fe+8OH--6e-=FeO42-+4H2O��
��1����Ӧ���ܷ�ӦʽΪMg+2NH4Cl=MgCl2+2NH3��+H2������2NH4+�������ϵõ�������NH3��H2��������ԭ��Ӧ�缫��ӦʽΪ2NH4++2e-=2NH3��+H2����
�ʴ�Ϊ��2NH4++2e-=2NH3��+H2����
��2��ÿ2molNO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ��ڼ�����Һ��Ӧ����NO3-��NO2-����Ӧ�����ӷ���ʽΪ2NO2+CO32-=NO3-+NO2-+CO2��
�ʴ�Ϊ��2NO2+CO32-=NO3-+NO2-+CO2��
���������⿼���Ϊ�ۺϣ��漰��ѧƽ�⡢ԭ��غ͵����Լ�������ԭ��Ӧ��֪ʶ����Ŀ�Ѷ��еȣ�ע����յ缫��Ӧʽ����д������

��ϰ��ϵ�д�
�����Ŀ
 ��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ��
��2011?����ģ�⣩һ�������������Ժ�CO2������Ӧ�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0 ��2012?��������ģ������һ����Ҫ�Ľ��������ĵ��ʼ����������Ÿ��Ե����ʣ�һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
��2012?��������ģ������һ����Ҫ�Ľ��������ĵ��ʼ����������Ÿ��Ե����ʣ�һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ����K�����¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��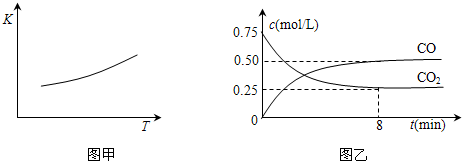
 FeO(s)+CO(g)����H>0
FeO(s)+CO(g)����H>0