题目内容
下列叙述不正确的是
- A.等温等压下,3mol C2H2(g) 和1molC6H6(g)的密度相等
- B.同质量、不同密度的N2和CO气体所含原子数一定相等
- C.温度和密度都相同,Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2)
- D.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
A
分析:A、等温等压下,气体摩尔体积相同,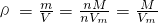 分析判断.
分析判断.
B、同质量的氮气和一氧化碳的物质的量相同,结合一个分子中含有的原子数判断含有的总原子数.
C、根据PV=nRT得,P=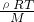 ,由此得出气体压强的相对大小.
,由此得出气体压强的相对大小.
D、根据N=nNA判断分子数的相对大小.
解答:A、等温等压下,气体摩尔体积相同,根据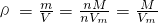 知,两种气体的摩尔质量不等导致其密度不等,故A错误.
知,两种气体的摩尔质量不等导致其密度不等,故A错误.
B、同质量的氮气和一氧化碳的物质的量相同,一个氮气分子和一个一氧化碳分子中含有的原子数相同,结合N=nNA知,同质量、不同密度的N2和CO气体所含原子数一定相等,故B正确.
C、根据PV=nRT得,P=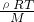 ,气体的温度和密度相同,由此知,气体的摩尔质量越大压强越小,所以Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2),故C正确.
,气体的温度和密度相同,由此知,气体的摩尔质量越大压强越小,所以Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2),故C正确.
D、根据N=nNA知,气体的分子数与物质的量成正比,与其它条件无关,所以等物质的量的乙烯和一氧化碳所含的分子数必相等,故D正确.
故选A.
点评:本题考查了阿伏伽德罗定律及推论,难点是C,要根据克拉伯龙方程分析解答,克拉伯龙方程在中学阶段已经不涉及,难度较大.
分析:A、等温等压下,气体摩尔体积相同,
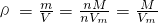 分析判断.
分析判断.B、同质量的氮气和一氧化碳的物质的量相同,结合一个分子中含有的原子数判断含有的总原子数.
C、根据PV=nRT得,P=
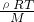 ,由此得出气体压强的相对大小.
,由此得出气体压强的相对大小.D、根据N=nNA判断分子数的相对大小.
解答:A、等温等压下,气体摩尔体积相同,根据
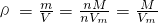 知,两种气体的摩尔质量不等导致其密度不等,故A错误.
知,两种气体的摩尔质量不等导致其密度不等,故A错误.B、同质量的氮气和一氧化碳的物质的量相同,一个氮气分子和一个一氧化碳分子中含有的原子数相同,结合N=nNA知,同质量、不同密度的N2和CO气体所含原子数一定相等,故B正确.
C、根据PV=nRT得,P=
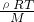 ,气体的温度和密度相同,由此知,气体的摩尔质量越大压强越小,所以Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2),故C正确.
,气体的温度和密度相同,由此知,气体的摩尔质量越大压强越小,所以Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2),故C正确.D、根据N=nNA知,气体的分子数与物质的量成正比,与其它条件无关,所以等物质的量的乙烯和一氧化碳所含的分子数必相等,故D正确.
故选A.
点评:本题考查了阿伏伽德罗定律及推论,难点是C,要根据克拉伯龙方程分析解答,克拉伯龙方程在中学阶段已经不涉及,难度较大.

练习册系列答案
相关题目
如图为元素周期表短周期的一部分.E原子的电子层数为n,最外层电子数为2n+1下列叙述不正确的是
( )
| A | B | C | |
| D | E |
| A、C和E氢化物的热稳定性和还原性均依次减弱 |
| B、A与B形成的阴离子可能有AB32-、A2B42- |
| C、AD2分子中每个原子的最外层均为8电子结构 |
| D、A、D、E的最高价氧化物对应的水化物的酸性依次增强 |