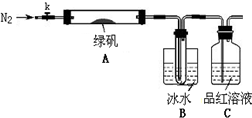
题目内容
如图所示,在一个小烧杯里加入研细的20g Ba(OH)2?8H2O晶体.
(1)将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌.实验中要用玻璃棒搅拌的原因是
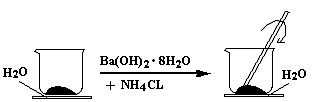
(2)写出有关反应的化学方程式:
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有
(4)通过最后一个现象可以说明该反应为
(1)将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌.实验中要用玻璃棒搅拌的原因是
该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应
该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应
.
(2)写出有关反应的化学方程式:
Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O
Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O
,该反应不是
不是
(填“是”或“不是”)氧化还原反应.(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有
玻璃片上因结冰而与小烧杯黏在一起
玻璃片上因结冰而与小烧杯黏在一起
.(4)通过最后一个现象可以说明该反应为
吸
吸
(填“吸”或“放”)热反应,这是由于反应物的总能量小于
小于
(填“大于”或“小于”)生成物的总能量.分析:(1)玻璃棒的搅拌作用还可以让化学反应快速发生;
(2)氢氧化钡和氯化铵反应生成氯化钡、氨气和水,所有复分解反应均不是氧化还原反应;
(3)烧杯和玻璃片之间的水结冰会将二者粘在一起;
(4)反应物的总能量小于生成物的总能量,则反应是一个吸热反应.
(2)氢氧化钡和氯化铵反应生成氯化钡、氨气和水,所有复分解反应均不是氧化还原反应;
(3)烧杯和玻璃片之间的水结冰会将二者粘在一起;
(4)反应物的总能量小于生成物的总能量,则反应是一个吸热反应.
解答:解:(1)Ba(OH)2?8H2O晶体和氯化铵晶体之间的反应是固体之间的反应,搅拌可使混合物充分接触并发生反应,
故答案为:该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应;
(2)氢氧化钡和氯化铵反应生成氯化钡、氨气和水,即Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O,该反应是复分解反应,不属于氧化还原反应,
故答案为:Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;不是;
(3)氢氧化钡晶体和氯化铵之间的反应是吸热的,玻璃片上因结冰而与小烧杯黏在一起,故答案为:玻璃片上因结冰而与小烧杯黏在一起;
(4)通过玻璃片上结冰现象,可以知道氢氧化钡晶体和氯化铵之间的反应是吸热的,反应物的总能量小于生成物的总能量,故答案为:吸;小于.
故答案为:该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应;
(2)氢氧化钡和氯化铵反应生成氯化钡、氨气和水,即Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O,该反应是复分解反应,不属于氧化还原反应,
故答案为:Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;不是;
(3)氢氧化钡晶体和氯化铵之间的反应是吸热的,玻璃片上因结冰而与小烧杯黏在一起,故答案为:玻璃片上因结冰而与小烧杯黏在一起;
(4)通过玻璃片上结冰现象,可以知道氢氧化钡晶体和氯化铵之间的反应是吸热的,反应物的总能量小于生成物的总能量,故答案为:吸;小于.
点评:本题考查学生氯化铵和氢氧化钡之间的反应是一个吸热反应,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
(15分)“旺旺雪饼”袋内有一个小纸袋,上面写着“干燥剂,主要成分是生石灰”。为此我对干燥剂的有关问题进行相关探究:
(1)问题1:为什么生石灰(CaO)可作干燥剂?(用化学方程式表示) 。
(2)我又对它作了一系列探究,获得较多收益,其有关实验方案如下:
|
问题与猜想 |
实验步骤 |
实验现象 |
实验结论 |
|
问题2:小纸袋中的物质 能否继续作干燥剂? |
取足量小纸袋中固体放入烧杯中,加入适量水,触摸杯壁。 |
|
不能作 干燥剂 |
|
问题3:我猜想变质后的物质可能是碳酸钙,该如何验证我的猜想? |
|
|
该干燥剂样品中有碳酸钙 |
(3)问题4:样品中碳酸钙的含量如何?某同学按如下流程进行实验:用盐酸溶解该干燥剂样品→干燥所得气体→用NaOH溶液吸收气体→根据NaOH溶液的增重计算该样品的含量,实验过程中所取该干燥剂样品的质量为10.0g。
实验装置如图所示:
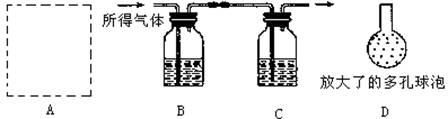 .
.
①A为溶解该干燥剂样品的装置,若已准备了长颈漏斗、双孔橡胶塞、导气管,为完成溶解至少还需要的实验仪器是 。
②A中发生反应的化学方程式为
③将插入溶液C中管子的下端改成具有多孔的球泡(如图中的D),有利于提高实验的准确度,其理由是 。
④当改进实验装置并进行正确操作后可以准确测定出干燥剂样品的含量(假设生成气体没有损失,并完全吸收)。若此时C装置在实验前后其质量增加了3.6g,则该干燥剂样品的含量为 %。
 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.