题目内容
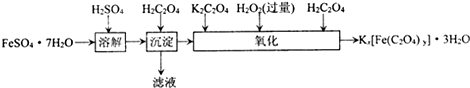
草酸合铁酸钾晶体Kx[Fe(C2O4)y]?3H2O可用于摄影和蓝色印刷.实验室制备草酸合铁酸钾晶体的实验流程如下: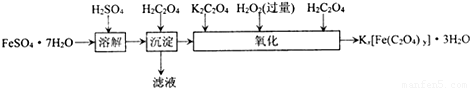
(1)若用铁和稀硫酸制备FeSO?7H2O,常保持______过量,理由是______.
(2)上述流程中,“沉淀”一步所得Fe(C2O4)?2H2O沉淀需用水洗涤.检验沉淀是否洗涤干净的方法是______.
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O
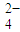 含量的实验步骤如下:
含量的实验步骤如下:步骤1:准确称取所制草酸合铁酸钾晶体ag(约1.5g),配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入6mol?L-1HCl 10mol,加热至70~80℃,趁热用SnCl2-TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10mL,在75~80℃下用0.01000mol?L-1 KMnO4标准溶液滴定至终点(Cl- 不参与反应),将C2O
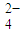 全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.
全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.步骤3:…
步骤4:重复上述步骤2~步骤3两次.
①步骤2操作时,还需要如图所示的仪器中的______(填序号).
②步骤2中MnSO4溶液的作用是______,滴定终点的现象是______.
③在不增加试剂种类的前提下,步骤3的目的是______.

【答案】分析:(1)亚铁离子易被空气中的氧气氧化为铁离子,需要加入过量的铁粉避免亚铁离子被氧化;
(2)沉淀洗净的办法是检验是否含有硫酸根离子的实验现象分析设计;
(3)①分析实验步骤分析可知,滴定实验是利用氧化还原反应的滴定过程测定草酸根离子的含量,需要把高锰酸钾溶液盛放在酸式滴定管中进行滴定实验,实验是在75~80℃下进行,需要水浴加热测定水的温度;
②实验步骤中加入的硫酸锰在滴定反应后未变化是做催化剂作用;滴定终点是利用高锰酸钾溶液的颜色进行判断;
③通过实验计算得到反应的定量关系和计算结果,是为了测定草酸根离子的含量.
解答:解:(1)亚铁离子易被空气中的氧气氧化为铁离子,需要加入过量的铁粉避免亚铁离子被氧化,2Fe3++Fe=3Fe2+;
故答案为:铁;防止亚铁离子被氧气氧化;
(2)沉淀洗净的办法是检验是否含有硫酸根离子,取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净;
故答案为:取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净;
(3)①由实验步骤分析可知,滴定实验是利用氧化还原反应的滴定过程测定草酸根离子的含量,需要把高锰酸钾溶液盛放在酸式滴定管中进行滴定实验,实验是在75~80℃下进行,需要水浴加热测定水的温度;
故答案为:ad;
②实验步骤中加入的硫酸锰在滴定反应后未变化是做催化剂作用;滴定终点是利用高锰酸钾溶液的颜色进行判断,滴入最后一滴高锰酸钾溶液溶液变为浅红色且半分钟不褪色证明反应达到终点;
故答案为:催化剂,溶液变为浅红色,且半分钟内部褪色;
③通过实验计算得到反应的定量关系和计算结果,是为了测定草酸根离子的含量;
故答案为:测定C2O42-的含量.
点评:本题考查了物质制备实验方法和分析判断,掌握实验基本操作和物质性质是解题关键,题目难度中等.
(2)沉淀洗净的办法是检验是否含有硫酸根离子的实验现象分析设计;
(3)①分析实验步骤分析可知,滴定实验是利用氧化还原反应的滴定过程测定草酸根离子的含量,需要把高锰酸钾溶液盛放在酸式滴定管中进行滴定实验,实验是在75~80℃下进行,需要水浴加热测定水的温度;
②实验步骤中加入的硫酸锰在滴定反应后未变化是做催化剂作用;滴定终点是利用高锰酸钾溶液的颜色进行判断;
③通过实验计算得到反应的定量关系和计算结果,是为了测定草酸根离子的含量.
解答:解:(1)亚铁离子易被空气中的氧气氧化为铁离子,需要加入过量的铁粉避免亚铁离子被氧化,2Fe3++Fe=3Fe2+;
故答案为:铁;防止亚铁离子被氧气氧化;
(2)沉淀洗净的办法是检验是否含有硫酸根离子,取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净;
故答案为:取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净;
(3)①由实验步骤分析可知,滴定实验是利用氧化还原反应的滴定过程测定草酸根离子的含量,需要把高锰酸钾溶液盛放在酸式滴定管中进行滴定实验,实验是在75~80℃下进行,需要水浴加热测定水的温度;
故答案为:ad;
②实验步骤中加入的硫酸锰在滴定反应后未变化是做催化剂作用;滴定终点是利用高锰酸钾溶液的颜色进行判断,滴入最后一滴高锰酸钾溶液溶液变为浅红色且半分钟不褪色证明反应达到终点;
故答案为:催化剂,溶液变为浅红色,且半分钟内部褪色;
③通过实验计算得到反应的定量关系和计算结果,是为了测定草酸根离子的含量;
故答案为:测定C2O42-的含量.
点评:本题考查了物质制备实验方法和分析判断,掌握实验基本操作和物质性质是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
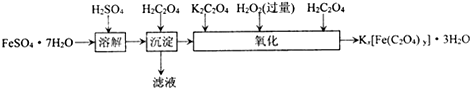

 含量的实验步骤如下:
含量的实验步骤如下: