题目内容
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
I.将NaOH 溶液与NH4Cl 溶液混合生成NH3·H2O,从而验证NaOH 的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理? 并说明理由:______________________________。
II.根据下图所示装置图回答以下问题。
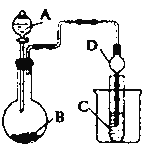
(1)利用如图装置可以验证非金属性的变化规律。干燥管D的作用是___________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:烧瓶中发生反应的离子方程式为_________。装置C中的实验现象为_________。
(3)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液 ②稀醋酸溶液 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为______(填序号)。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是________。
【答案】 不合理,NH3·H2O并非为N的最高价氧化物对应的水化物 防倒吸 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 有淡黄色沉淀 ①④ HNO3有挥发性,也会和硅酸钠反应生成硅酸
【解析】试题分析:本题考查元素性质递变规律的探究实验,侧重考查实验方案的设计和评价。
I.将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,反应的化学方程式为NaOH+NH4Cl=NaCl+NH3·H2O,通过该反应证明NaOH的碱性大于NH3·H2O,但不能证明Na的金属性大于N,因为NH3·H2O不是N的最高价氧化物对应的水化物,该设计不合理。
II.(1)根据装置图,干燥管D的作用是防倒吸。
(2)根据题给试剂,要验证Cl的非金属性大于S,反应的原理为Cl2+Na2S=2NaCl+S↓;A与B反应制备Cl2,由于该装置中没有酒精灯,所以用KMnO4和浓盐酸在圆底烧瓶中反应制Cl2,烧瓶中反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;试管C中为Cl2与Na2S的反应,实验现象为:有淡黄色沉淀。
(3)根据题给试剂,要证明非金属性:N![]() C
C![]() Si应通过证明酸性:HNO3
Si应通过证明酸性:HNO3![]() H2CO3
H2CO3![]() H2SiO3,根据强酸制弱酸的复分解反应规律,反应的原理为:圆底烧瓶中发生的反应为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,试管中发生的反应为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,则试剂A为①稀HNO3溶液,试剂B为③碳酸钙,试剂C为④Na2SiO3溶液。有同学认为此实验不能说明N、C、Si的非金属性强弱,原因是HNO3具有挥发性,所得CO2中混有HNO3,HNO3也会与Na2SiO3溶液反应产生H2SiO3沉淀,试管中产生白色沉淀不能说明H2CO3的酸性强于H2SiO3,不能说明非金属性C大于Si。
H2SiO3,根据强酸制弱酸的复分解反应规律,反应的原理为:圆底烧瓶中发生的反应为2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑,试管中发生的反应为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,则试剂A为①稀HNO3溶液,试剂B为③碳酸钙,试剂C为④Na2SiO3溶液。有同学认为此实验不能说明N、C、Si的非金属性强弱,原因是HNO3具有挥发性,所得CO2中混有HNO3,HNO3也会与Na2SiO3溶液反应产生H2SiO3沉淀,试管中产生白色沉淀不能说明H2CO3的酸性强于H2SiO3,不能说明非金属性C大于Si。

 名校课堂系列答案
名校课堂系列答案