题目内容
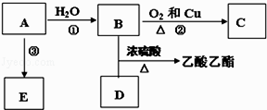
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、干冰、金刚石、石墨结构中的某一种的某一部分。
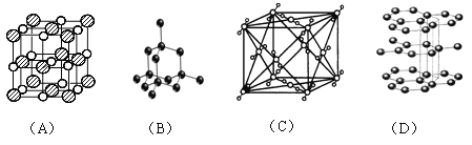
(1)其中代表金刚石的是(填编号字母,下同)_____,金刚石属于_____晶体。
(2)其中代表石墨的是_________,其晶体中碳原子呈平面_________结构排列。
(3)其中代表NaCl的是_________,晶体中Na+与Cl-之间通过__________键结合起来。
(4)代表干冰的是_______,它属于_______晶体,CO2分子间通过_____________结合起来。
(5)上述物质中(A)(B)(C)三者的熔点由高到低的排列顺序为_______________。(填编号字母)
【答案】 B 原子 D 层状 A 离子键 C 分子 范得华力(或分子间作用力) (B)>(A)>(C)
【解析】(1)金刚石是原子晶体,属于正四面体结构,代表金刚石的是B。(2)石墨是层状结构,代表石墨的是D,其晶体中碳原子呈平面层状结构排列。(3)氯化钠是离子晶体,代表NaCl的是A,晶体中Na+与Cl-之间通过离子键结合起来。(4)干冰是固态二氧化碳,属于分子晶体,代表干冰的是C,CO2分子间通过范得华力(或分子间作用力)结合起来。(5)一般情况原子晶体的熔点高于离子晶体,离子晶体高于分子晶体,则上述物质中(A)(B)(C)三者的熔点由高到低的排列顺序为(B)>(A)>(C)。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.
向硝酸酸化的0.05molL﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
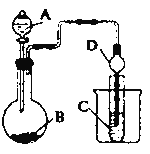
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 . 
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .