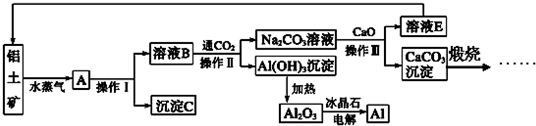
题目内容
请回答下列问题:
(1)①[Cu(NH3)4]2+中存在的化学键类型有
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素(核电荷数24),该元素基态原子的电子排布式是
(3)利用CO可以合成化工原料COCl2,则COCl2分子内含有
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3个σ键、1个π键
(4)按要求写出第二周期非金属元素组成的中性分子的化学式及中心原子的杂化方式.三角锥形分子:分子式
(5)用价层电子对互斥理论推断第ⅣA族元素Sn形成的SnBr2分子中Sn-Br的键角
(6)已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(1)①[Cu(NH3)4]2+中存在的化学键类型有
AC
AC
(填序号).A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
平面正方型
平面正方型
.(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素(核电荷数24),该元素基态原子的电子排布式是
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,与它同周期的基态原子中最外层电子数与铬相同的元素有Cu、K
Cu、K
(填元素符号).(3)利用CO可以合成化工原料COCl2,则COCl2分子内含有
D
D
(填标号).A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3个σ键、1个π键
(4)按要求写出第二周期非金属元素组成的中性分子的化学式及中心原子的杂化方式.三角锥形分子:分子式
NF3
NF3
,杂化方式是sp3
sp3
;(5)用价层电子对互斥理论推断第ⅣA族元素Sn形成的SnBr2分子中Sn-Br的键角
<
<
120°(填“>”“<”或“=”).(6)已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
C>H>Si
C>H>Si
.分析:(1)①[Cu(NH3)4]2+中存在配位键和极性共价键;
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(2)Cr是24号元素,其原子核外有24个电子,根据构造原理写出其基态原子核外电子排布式,Cr原子有最外层有1个电子,第四周期元素中,当d能级电子数全满或全空且最外层有一个电子的元素各一种;
(3)COCl2分子中碳氧之间存在双键,碳原子和氯原子之间存在单键,COCl2分子的结构式,据此判断C=O键中含有1个δ键,1个π键;
(4)第二周期非金属元素组成的中性分子,如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4;
(5)首先判断价层电子对数目和有无孤电子对,进而判断分子的空间构型;
(6)根据吸电子能力强的原子电负性大分析.
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(2)Cr是24号元素,其原子核外有24个电子,根据构造原理写出其基态原子核外电子排布式,Cr原子有最外层有1个电子,第四周期元素中,当d能级电子数全满或全空且最外层有一个电子的元素各一种;
(3)COCl2分子中碳氧之间存在双键,碳原子和氯原子之间存在单键,COCl2分子的结构式,据此判断C=O键中含有1个δ键,1个π键;
(4)第二周期非金属元素组成的中性分子,如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4;
(5)首先判断价层电子对数目和有无孤电子对,进而判断分子的空间构型;
(6)根据吸电子能力强的原子电负性大分析.
解答:解:(1)(3)①[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,故答案为:A、C;
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:平面正方型;
(2 ) Cr是24号元素,其原子核外有24个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p63d54s1,第四周期元素中,当d能级电子数全满或全空且最外层有一个电子的元素分别是Cu、K,
故答案为:1s22s22p63s23p63d54s1;Cu、K;
(3)COCl2分子的结构式为: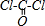 ,C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,故选D;
,C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,故选D;
(4)第二周期非金属元素组成的中性分子,如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4,则该分子是NF3,氮原子采取sp3杂化,
故答案为:NF3;sp3杂化;
(5)SnBr2分子中,Sn原子的价层电子对数目是
=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°,故答案为:<;
(6)根据共用电子对偏向电负性大的原子,已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,故有C>H>Si,
故答案为:C>H>Si.
②形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,
故答案为:平面正方型;
(2 ) Cr是24号元素,其原子核外有24个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p63d54s1,第四周期元素中,当d能级电子数全满或全空且最外层有一个电子的元素分别是Cu、K,
故答案为:1s22s22p63s23p63d54s1;Cu、K;
(3)COCl2分子的结构式为:
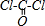 ,C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,故选D;
,C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,故选D;(4)第二周期非金属元素组成的中性分子,如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4,则该分子是NF3,氮原子采取sp3杂化,
故答案为:NF3;sp3杂化;
(5)SnBr2分子中,Sn原子的价层电子对数目是
| 4+2 |
| 2 |
(6)根据共用电子对偏向电负性大的原子,已知CH4中共用电子对偏向C,SiH4中共用电子对偏向H,故有C>H>Si,
故答案为:C>H>Si.
点评:此知识点为选修内容,本题综合考查了原子杂化方式、电负性、价层电子对互斥理论、电子排布式的书写等知识,知识点全面,题目难度中等,学生在学习过程中重点在于能利用模型解决问题,侧重于方法.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: