题目内容
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO﹣和ClO3﹣的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1
【答案】D
【解析】解:Cl2被氧化生成ClO﹣与ClO3﹣ , Cl2还原有生成NaCl,ClO ﹣与ClO3﹣的离子个数比为1:3,假设ClO ﹣与ClO3﹣的物质的量分别为1mol、3mol,根据电子转移守恒,Cl﹣的物质的量= ![]() =16mol,根据Cl原子守恒,被还原的氯原子与被氧化的氯原子的个数比=16mol:(3mol+1mol)=4:1,
=16mol,根据Cl原子守恒,被还原的氯原子与被氧化的氯原子的个数比=16mol:(3mol+1mol)=4:1,
故选D.
化合价升高的元素钡氧化,化合价降低的元素被还原,Cl2被氧化生成ClO﹣与ClO3﹣ , Cl2还原有生成NaCl,ClO ﹣与ClO3﹣的离子个数比为1:3,假设ClO ﹣与ClO3﹣的物质的量分别为1mol、3mol,根据电子转移守恒计算ClO﹣的物质的量,再根据Cl原子守恒计算被还原的氯原子与被氧化的氯原子的个数比.

【题目】(1)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g) +1/2O2(g)![]() SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
(2)下表列出了常见的烟气脱硝的两种方法
编号 | 名称 | 原理 |
方法一 | 尿素法 | 在温度70—95℃时,尿素CO(NH2)2溶液吸收NO、NO2,将其转化为N2 |
方法二 | 选择性催化还原( SCR)法 | 以NH3等作为还原剂,将烟气中的NOx还原生成N2和H2O |
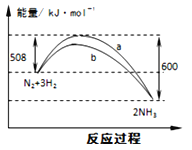
已知:N2(g)+O2(g)=2NO(g) △H=+180.6 kJ·mol—1
N2(g)+3H2(g)=2NH3(g) △H= -92.4kJ·mol—1
2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol—1
则4NO(g) +4NH3(g)+O2(g)=4N2(g)+6H2O(g);△H=_________ kJ·mol-1。
(3)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。

①该反应的ΔH_______0(选填“<”、“>”或“=”,下同),K1_________K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有___。