题目内容
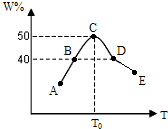
将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.
(1)前10sB容器中的平均反应速率v(Y)=______;此反应的正反应为______热反应;
(2)10s时A容器中v正______v逆(填=、>或<,下同);B、D两容器中正反应速率关系vB______vD.
(3)若10s时C点生成物W的体积分数为50.0%,则X的转化率为______.
(4)若10s时保持E容器的温度与体积不变,向E容器中中通入0.6molW,要求重新达到平衡时混合物中各组分的百分含量不变,则此时还需同时通入______mol反应物Y.
(1)前10sB容器中的平均反应速率v(Y)=______;此反应的正反应为______热反应;
(2)10s时A容器中v正______v逆(填=、>或<,下同);B、D两容器中正反应速率关系vB______vD.
(3)若10s时C点生成物W的体积分数为50.0%,则X的转化率为______.
(4)若10s时保持E容器的温度与体积不变,向E容器中中通入0.6molW,要求重新达到平衡时混合物中各组分的百分含量不变,则此时还需同时通入______mol反应物Y.

(1)2X(g)+Y(g)?3W(g)
起始(mol) 22 0
反应(mol) 2a a 3a
10s末(mol)2-2a 2-a 3a
10s末W的体积百分含量为
×100%=40%,解得:a=0.53,
前10sB容器中的平均反应速率v(Y)=
=
=2.7×10-2mol/L?s;
随着温度的继续升高,W的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,
故答案为:2.7×10-2mol/L?s;放;
(2)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,10s时A、B容器中未到达平衡,10s时A容器中v正>v逆,
根据温度越高,化学反应速率越,所以B、D两容器中正反应速率关系vB<vD
故答案为:>;<;
(3)2X(g)+Y(g)?3W(g)
起始(mol) 2 2 0
反应(mol) 2a a 3a
10s末(mol)2-2a 2-a 3a
10s末W的体积百分含量为
×100%=50%,解得:a=0.667,
则X的转化率为
×100%=66.7%;
故答案为:66.7%;
(4)2X(g)+Y(g)?3W(g).
0.4mol 0.2mol 0.6mol
则有
=
,解得:n(Y)=0.2mol;
故答案为:66.7%;0.2;
起始(mol) 22 0
反应(mol) 2a a 3a
10s末(mol)2-2a 2-a 3a
10s末W的体积百分含量为
| 3a |
| 4 |
前10sB容器中的平均反应速率v(Y)=
| ||
| △t |
| ||
| 10s |
随着温度的继续升高,W的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,
故答案为:2.7×10-2mol/L?s;放;
(2)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,10s时A、B容器中未到达平衡,10s时A容器中v正>v逆,
根据温度越高,化学反应速率越,所以B、D两容器中正反应速率关系vB<vD
故答案为:>;<;
(3)2X(g)+Y(g)?3W(g)
起始(mol) 2 2 0
反应(mol) 2a a 3a
10s末(mol)2-2a 2-a 3a
10s末W的体积百分含量为
| 3a |
| 4 |
则X的转化率为
| 2a |
| 2 |
故答案为:66.7%;
(4)2X(g)+Y(g)?3W(g).
0.4mol 0.2mol 0.6mol
则有
| 0.4 |
| 0.2+n(Y) |
| 2 |
| 2 |
故答案为:66.7%;0.2;

练习册系列答案
相关题目
 CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。 ?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
?H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下