题目内容
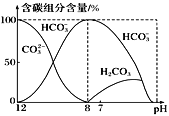
【题目】常温下在20mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法不正确的是
A.在同一溶液中,H2CO3、![]() 、
、![]() 不能大量共存
不能大量共存
B.测定混有少量氯化钠的碳酸钠的纯度,若用滴定法,指示剂可选用酚酞
C.当pH=7时,溶液中各种离子的物质的量浓度的大小关系: c(Na+)>c(Cl-)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
D.已知在25℃时,![]() 水解反应的平衡常数即水解常数Kh1 =2.0×10-4,溶液中c(
水解反应的平衡常数即水解常数Kh1 =2.0×10-4,溶液中c(![]() )∶c(
)∶c(![]() )=1∶1时,溶液的pH=10
)=1∶1时,溶液的pH=10
【答案】D
【解析】
A.根据图像分析,pH>8时只有碳酸根离子和碳酸氢根离子,pH=8时,只有碳酸氢根离子,pH<8时,溶液中只有碳酸和碳酸氢根离子,则在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故A正确;
B.Na2CO3溶液中逐滴加入HCl溶液,用酚酞作指示剂,滴定产物是![]() ,用甲基橙作指示剂滴定时,
,用甲基橙作指示剂滴定时,![]() 和HCl溶液的反应产物是H2CO3,故B正确;
和HCl溶液的反应产物是H2CO3,故B正确;
C.由图象可知,pH=7时,c(H+)=c(OH-),溶液中含碳元素的主要微粒为HCO3-、H2CO3,电荷守恒可知:c(Na+)+c(H+)=c(Cl)+c(HCO3-)+c(OH),则c(Na+)>c(Cl),因HCO3-水解,则c(Na+)>c(Cl)>c(HCO3-),溶液中各种离子的物质的量浓度的大小关系为c(Na+)>c(Cl)>c(HCO3-)>c(H+)=c(OH),故C正确;
D.已知在25℃时,溶液中c(![]() )∶c(
)∶c(![]() )=1∶1,
)=1∶1,![]() 水解反应的平衡常数即水解常数Kh1 =
水解反应的平衡常数即水解常数Kh1 =![]() c(OH-)=2.0×10-4,则c(H+)
c(OH-)=2.0×10-4,则c(H+)![]()
![]() =5.0×10-11,溶液的pH<10,故D错误;
=5.0×10-11,溶液的pH<10,故D错误;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中 NaOH 的质量分数,进行如下步骤实验:
① 称量 1.0g 样品溶于水,配成 250 mL 溶液;
② 准确量取 25.00 mL 所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用 0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)称量1.0g 样品,除小烧杯、药匙外,所用到的主要仪器有_________。
(2)将样品配成 250 mL 溶液,除小烧杯、玻璃棒外,还需用到的玻璃仪器有_________。
(3)用_________滴定管(填“酸式”或“碱式”)盛装 0.10mol/L 的盐酸标准液。
(4)观察滴定到终点时溶液颜色的变化为_________。
(5)烧碱样品的纯度为_________。
(6)若出现下列情况,测定结果偏高的是_________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.盛装标准液的滴定管水洗后未用标准液再润洗
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是___________价,其基态原子电子排布式为___________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是___________。
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为___________。
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为___________。但NF3不易与Cu2+形成化学键,其原因是___________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为___________。
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为___________个,二者的最短距离为___________pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为___________g·cm-3。