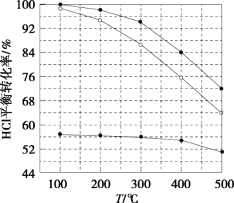
题目内容
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
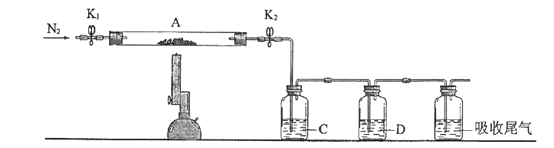
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00 mL 7.0 mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00 mL,用2.00 mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50 mL。
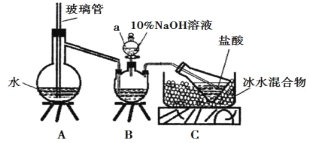
步骤二,氯的测定:准确称取橙黄色晶体w g,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是_________;
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在_____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将______(填“偏高”“偏低”或“无影响”);冰水混合物的作用是_______________。
(5)测定氯的过程中,使用棕色滴定管的原因是________
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1∶6∶3,其中氮元素以氨的形式存在。制备M的化学方程式为_____,其中双氧水的作用是____;制备M的过程中温度不能过高的原因是_____。
【答案】平衡气压(当A中压力过大时,安全管中液面上升,使A瓶中压力稳定) A 42.00 偏高 减少盐酸的挥发,有利于氨气的吸收 AgNO3见光易分解 2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)6]Cl3+2H2O 氧化剂 温度过高过氧化氢分解、氨气逸出
【解析】
根据盐酸和氢氧化钠的量计算氨气的物质的量,根据硝酸银计算氯离子的物质的量。注意分析合成M的原料中双氧水的作用。
(1)上述装置A中,玻璃管的作用是平衡气压(当A中压力过大时,安全管中液面上升,使A瓶中压力稳定);
(2)装置A、B三脚架处应放置一个酒精灯作为热源,A装置要产生水蒸气将B中的氨全部蒸出,酒精灯应放置在A处。
(3)步骤一所称取的样品中含氮的质量为![]() 42.00g。
42.00g。
(4)装置C中所用盐酸的浓度过大易挥发,相当于氨气消耗盐酸过多,会造成测得氮的含量偏高;为减少盐酸的挥发,冰水混合物的作用降低吸收液盐酸的温度,减少盐酸的挥发,有利于氨气的吸收。
(5)硝酸银见光会分解,故测定氯的过程中使用棕色滴定管的原因是防止AgNO3见光分解。
(6)M以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1∶6∶3,其中氮元素以氨的形式存在,双氧水将+2价钴氧化为+3,则M为配合物,其化学式为[Co(NH3)6]Cl3,因此,制备M的化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2=2[Co(NH3)6]Cl3+2H2O,其中双氧水的作用是氧化剂;双氧水和氨水受热均易分解,故制备M的过程中温度不能过高的原因是:温度过高过氧化氢分解、氨气逸出。

 阅读快车系列答案
阅读快车系列答案【题目】锗是重要的半导体材料之一。碳、硅、锗位于同主族。
(1)基态锗原子的价层电子排布式为__________________。
(2)几种晶体的熔点和硬度如表所示。
晶体 | 金刚石 | 碳化硅 | 二氧化硅 | 硅 | 锗 |
熔点/℃ | 3 550 | 2 700 | 1 710 | 1 410 | 1 211 |
硬度 | 10 | 9.5 | 7 | 6.5 | 6.0 |
①碳化硅的晶体类型是__________________。
②二氧化硅的熔点很高,而干冰(固体二氧化碳)易升华,其主要原因是__________________。
③硅的熔点高于锗的,其主要原因是___________________________。
(3)![]() 的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
的立体构型是________________;GeCl4分子中锗的杂化类型是__________________。
(4)1个CS2分子中含_________个π键。
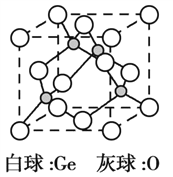
(5)锗的氧化物晶胞如图所示。已知:该氧化物的摩尔质量为M g·mol1,NA代表阿伏加德罗常数的值,晶胞密度为 ρ g·cm3。该晶胞的化学式为_________。氧原子的配位数为_________。该晶胞参数为_________cm(用代数式表示)。
 。
。