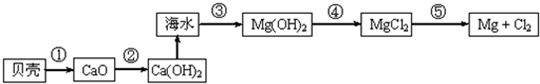
题目内容
下列实验操作中正确的是( )
| A.用洁净的铂丝蘸取某溶液放在酒精灯火焰上灼烧,若火焰呈黄色,说明溶液中含有Na+ |
| B.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,说明一定有CO32- |
| C.加石灰水并加热有刺激性气味的气体产生,能使紫色石蕊试纸变为蓝色,说明一定有NH4+ |
| D.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
A.金属阳离子的检验常用焰色反应,如Na+焰色为黄色,K+焰色为紫色(透过兰色钴玻璃观察),根据题意用洁净的铂丝蘸取某溶液放在酒精灯火焰上灼烧,若火焰呈黄色,黄色是Na+的焰色,即可说明溶液中含有Na+,故A正确;
B.能使澄清石灰水变浑浊的气体常见的有CO2、SO2等,发生Ca(OH)2+CO2═CaCO3↓+H2O、Ca(OH)2+SO2═CaSO3↓+H2O反应,CaCO3↓、CaSO3↓都为白色沉淀.某溶液中加入稀盐酸产生的无色气体如果是CO2,则溶液中可能含有CO32-或HCO3-,反应为CO32-+2H+═CO2↑+H2O或HCO3-+H+═CO2↑+H2O.所以某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,可能有CO32-、HCO3-、SO32-、HSO3-等,故B错误;
C.加石灰水并加热有刺激性气味的气体产生,能使紫色石蕊试纸变为蓝色,氨气能使紫色石蕊试纸变蓝,这里试纸必须是湿润的(或者氨气中有水汽),这样氨气才能溶解到水中,显碱性.否则干燥的氨气是不能使试纸变色的.而题意中并未说明紫色石蕊试纸湿润,因此并不能说明紫色石蕊试纸一定变为蓝色,也就无法证明一定有NH4+,故C错误;
D.不溶于盐酸的白色沉淀如BaSO4、AgCl等.加入氯化钡溶液有白色沉淀产生,白色沉淀可能BaSO4或AgCl,反应为Ba2++SO42-═BaSO4↓、Ag++Cl-═AgCl↓,因此溶液中可能含有SO42-或
Ag+,故D错误;
故选A.
B.能使澄清石灰水变浑浊的气体常见的有CO2、SO2等,发生Ca(OH)2+CO2═CaCO3↓+H2O、Ca(OH)2+SO2═CaSO3↓+H2O反应,CaCO3↓、CaSO3↓都为白色沉淀.某溶液中加入稀盐酸产生的无色气体如果是CO2,则溶液中可能含有CO32-或HCO3-,反应为CO32-+2H+═CO2↑+H2O或HCO3-+H+═CO2↑+H2O.所以某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,可能有CO32-、HCO3-、SO32-、HSO3-等,故B错误;
C.加石灰水并加热有刺激性气味的气体产生,能使紫色石蕊试纸变为蓝色,氨气能使紫色石蕊试纸变蓝,这里试纸必须是湿润的(或者氨气中有水汽),这样氨气才能溶解到水中,显碱性.否则干燥的氨气是不能使试纸变色的.而题意中并未说明紫色石蕊试纸湿润,因此并不能说明紫色石蕊试纸一定变为蓝色,也就无法证明一定有NH4+,故C错误;
D.不溶于盐酸的白色沉淀如BaSO4、AgCl等.加入氯化钡溶液有白色沉淀产生,白色沉淀可能BaSO4或AgCl,反应为Ba2++SO42-═BaSO4↓、Ag++Cl-═AgCl↓,因此溶液中可能含有SO42-或
Ag+,故D错误;
故选A.

练习册系列答案
相关题目