题目内容
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
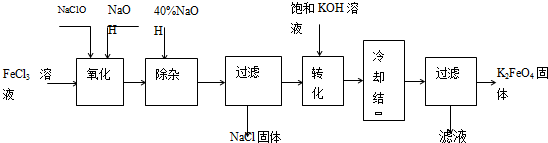
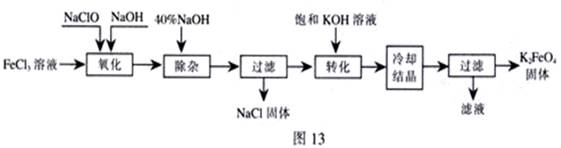
方法Ⅰ:次氯酸盐氧化法。工艺流程如图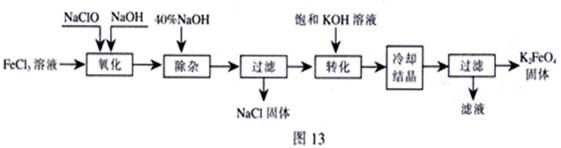
(1)“氧化”过程中的氧化剂是 (填化学式)。比较NaClO、Na2FeO4的氧化性强弱(填<、=、>) 。
“除杂”除去的是 。
(2)“转化”过程中发生的化学反应方程式为 ,与我们见过的分离 混合物的原理相似。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用 溶解,然后 。
方法Ⅱ:电解法。
(4)以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入 。
(1)NaClO > NaCl(3×2分)
(2)Na2FeO4+2KOH=K2FeO4+2NaOH KCl、NaNO3(2×2分)
(3)稀KOH溶液(2分),然后加入饱和KOH溶液、冷却结晶、过滤。(1×3分)
说明:若用“水”溶解粗产品,不得分;若用“稀NaOH溶液”,得1分。
(4)饱和KOH(1分)
解析

练习册系列答案
相关题目
新型净水剂-高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH═K2FeO4+2NaOH.下列说法不正确的是( )
②Na2FeO4+2KOH═K2FeO4+2NaOH.下列说法不正确的是( )
| A、反应①为氧化还原反应,反应②为复分解反应 | B、反应①中氧化产物与还原产物物质的量之比为2:9 | C、反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 | D、若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |