题目内容
4. 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:(1)写出反应的离子方程式Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
(2)下列三种情况下,离子方程式与(1)相同的是A(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
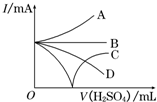
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是C(填序号).
(4)若向装有KAl(SO4)2溶液烧杯里缓缓滴入Ba(OH)2溶液至SO42-恰好完全反应.则反应的离子方程式是Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
分析 (1)氢氧化钡与硫酸反应生成硫酸钡沉淀;
(2)A.NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,反应生成硫酸钠、硫酸钡和水;
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,反应生成硫酸钡、氢氧化钠和水;
(3)加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强;
(4)向KAl(SO4)2溶液中滴加Ba(OH )2溶液,使SO42-恰好完全沉淀,生产硫酸钡和偏铝酸钾.
解答 解:(1)向Ba(OH)2溶液中逐滴加入稀硫酸,离子方程式为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(2)A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A正确;
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故B错误;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,故C错误;
故选:A;
(3)加入稀硫酸直至过量,恰好反应时导电性为0,过量后离子浓度增大,导电性增强,图中只有C符合,
故答案为:C;
(4)假设SO42-的物质的量为2mol,则明矾溶液中含有2mol SO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故答案为:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
点评 本题考查离子反应方程式的书写,为高考常见的题型,题目难度中等,涉及与量有关的离子反应、导电性等,把握反应的实质即可解答,试题有利于培养学生灵活应用所学知识的能力.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | KCl | B. | SiO2 | C. | Na2O2 | D. | HNO3 |
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 三氯化铁溶液跟氨水反应:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| D. | 常温下将氯气通入氢氧化钠溶液:2Cl2+2OH-═3Cl-+ClO-+H2O |
| A. | 将40 g NaOH溶于1 L水所得的溶液 | |
| B. | 将80 g SO3溶于水并配成1 L的溶液 | |
| C. | 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液 | |
| D. | 含K+为2 mol的K2SO4溶液 |
| A. | “双吸剂”中的无机盐和生石灰都有吸水作用 | |
| B. | “双吸剂”吸收水时,发生了原电池反应 | |
| C. | 吸收氧气的过程中,铁粉作原电池的正极 | |
| D. | 炭粉上发生的反应为:O2+4e-+2H2O=4OH- |
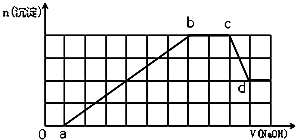
| A. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | |
| B. | ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | |
| C. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ | |
| D. | d点溶液中含有的溶质只有Na2SO4 |
| A. | 燃烧反应 | B. | 加成反应 | C. | 取代反应 | D. | 裂解反应 |
 已知咖啡酸的结构如图所示.
已知咖啡酸的结构如图所示.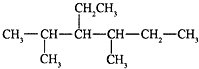 2,4二甲基-3-乙基己烷
2,4二甲基-3-乙基己烷