题目内容
【题目】常温下,用0.10 mol·L-1的氨水滴定20.00 mL a mol·L-1的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。下列说法不正确的是
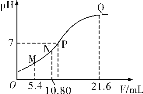
A. 图上四点对应溶液中离子种类相同
B. 若N点溶液中存在c(H+)=c(OH-)+c(NH3·H2O) ,则N点为滴定反应的恰好反应点
C. 图上四点对应的溶液中水的电离程度由大到小排列为N>P>M>Q
D. 若N点为恰好反应点,则M点溶液中存在c(Cl-)=2c(NH3·H2O)+2c(NH4+)
【答案】C
【解析】
A.四点对应的溶液中均存在: H+、 OH-、NH![]() 、Cl-,故A正确;
、Cl-,故A正确;
B. 若N点溶液中存在c(H+)=c(OH-)+c(NH3·H2O),根据质子守恒定律,可知c(H+)=c(OH-)+c(NH3·H2O)为NH4Cl溶液中的质子守恒,B正确;
C.无法比较N点和P点影响水电离的程度,故C错误;
D.M点溶液中c(NH4Cl)=c(HCl),则根据氯原子和氮原子守恒,故D正确;
故选C。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目