题目内容
【题目】下列说法正确的是( )
|
|
|
|
① | ② | ③ | ④ |
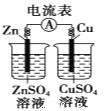
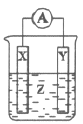
A.装置①表示已组装的铜锌原电池
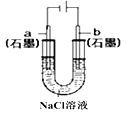
B.装置②工作一段时间后,a极附近溶液的pH减小
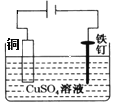
C.装置③可以在铁钉上镀铜
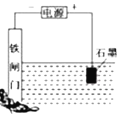
D.装置④保护铁闸门不被腐蚀,为牺牲阳极的阴极保护法
【答案】C
【解析】
A、该原电池装置中缺少盐桥,不能形成闭合回路,不能构成原电池,故A错误;
B、该装置为电解池,a极为阴极,发生的电极反应为:2H2O+2e-=H2↑+2OH-,附近的pH增加,故B错误;
C、该电解池阳极(铜)反应为:Cu-2e-=Cu2+,阴极(铁钉)反应为:Cu2++2e-=Cu,由此可知,该装置可以在铁钉上镀铜,故C正确;
D、该装置铁闸门连接电源负极,作电解池阴极从而被保护,该方法为外加电流的阴极保护法,故D错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下述实验不能达到预期实验目的是( )
序号 | 实验内容 | 实验目的 |
A | 将 | 配制质量分数为 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 将少量某有机物滴加到新制氢氧化铜悬浊液中,观察是否有红色沉淀生成 | 检验该有机物中是否含有醛基 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的 | 研究浓度对反应速率的影响 |
A.AB.BC.CD.D