题目内容
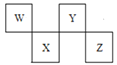
【题目】W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。
请回答下列问题。
(1)H2Y2的电子式为___________,Z在周期表中的位置___________。
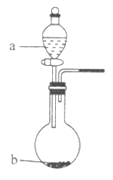
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________极,其电极反应式为____________________。
【答案】![]() 第三周期ⅦA族 2Fe2++3H2O2+4I-=2Fe(OH)3+2I2 Na2O(s)+1/2O2(g)=Na2O2(s)△H=-97kJ/mol 正极 Cl2+2e-=2Cl-
第三周期ⅦA族 2Fe2++3H2O2+4I-=2Fe(OH)3+2I2 Na2O(s)+1/2O2(g)=Na2O2(s)△H=-97kJ/mol 正极 Cl2+2e-=2Cl-
【解析】
W、X、Y、Z四种短周期元素,由元素在元素周期表中的位置,可知W、Y处于第二周期,X、Z处于第三周期,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物,则Y为O元素,可推知W为C元素、X为P、Z为Cl。
(1)H2O2分子中O原子之间形成1对共用电子对、H原子与O原子之间形成1对共用电子对,其电子式为![]() ;Z为Cl元素,处于第三周期ⅦA族,故答案为
;Z为Cl元素,处于第三周期ⅦA族,故答案为![]() ;第三周期ⅦA族;
;第三周期ⅦA族;
(2)在图2中,将H2O2的水溶液滴入含有Fe2+和淀粉KI的水溶液,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成,说明反应生成氢氧化铁与碘单质.当消耗2molI-时,共转移3mol电子,则参加反应的Fe2+物质的量为![]() =1mol,参加反应H2O2的物质的量=
=1mol,参加反应H2O2的物质的量=![]() =1.5mol,故Fe2+、H2O2、I-的化学计量数之比=2:3:4,该反应离子方程式为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2,故答案为2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;
=1.5mol,故Fe2+、H2O2、I-的化学计量数之比=2:3:4,该反应离子方程式为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2,故答案为2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;
(3)根据题意可知:①2Na(s)+![]() O2(g)=Na2O(s)△H=-414kJ/mol,②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ/mol根据盖斯定律,②-①得Na2O(s)+
O2(g)=Na2O(s)△H=-414kJ/mol,②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ/mol根据盖斯定律,②-①得Na2O(s)+![]() O2(g)=Na2O2(s)△H=-97kJ/mol,故答案为Na2O(s)+
O2(g)=Na2O2(s)△H=-97kJ/mol,故答案为Na2O(s)+![]() O2(g)=Na2O2(s)△H=-97kJ/mol;
O2(g)=Na2O2(s)△H=-97kJ/mol;
(4)氯气获得电子生成Cl-,发生还原反应,应在原电池正极通入,电极反应式为:Cl2+2e-=2Cl-,故答案为正;Cl2+2e-=2Cl-。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】下列反应中,属于消去反应的是
A.CH2=CH2+HCl 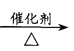 CH3CH2Cl
CH3CH2Cl
B.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
C.![]() +Br2
+Br2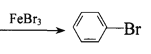 +HBr
+HBr
D.CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O
CH2=CH2+NaBr+H2O
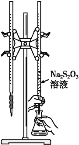
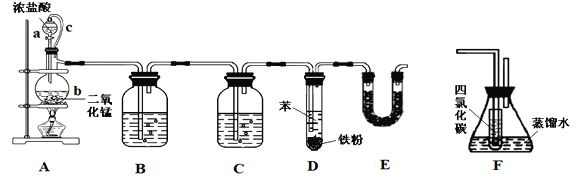
【题目】氯苯在染料、医药工业中有广泛的应用,某实验小组利用如下装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)装置A中橡胶管c的作用是______________,装置E的作用是__________________。
(2)实验时;使a中的浓盐酸缓缓滴下,可观察到仪器b内的现象是________________,写出反应的离子方程式______________________________________。
(3)为证明氯气和苯发生的是取代而不是加成反应,该小组用装置F说明,则装置F置于________之间(填字母),F中小试管内CCl4的作用是___________________,还需使用的试剂是______________。
(4)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0 g,则氯苯的产率为_________%(保留三位有效数字)。