题目内容
【题目】I.在容器为1L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:
2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:

(1)100℃时,在0~60s时段,反应速率v(N2O4)为______mol/(L·s),反应的平衡常数K为_______。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol/(L·s)平均速率降低,经10s又达到平衡.T_____100℃(填“大于”或“小于”),判断理由是_________。
II.利用LiOH和钴氧化物可制备锂离子电池。正极材料LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图16所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为_____溶液(填化学式),阳极电极反应式为__________________。

(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钻氧化物的艺流程如图17:

Co(OH)3在酸溶并发生氧化还原反应时的离子方程式为______________________。在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体的质量为2.73g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_____________。
【答案】 0.0010 0.36mol·L1 大于 正反应方向吸热,温度改变后平衡向正反应方向移动(正反应速率大于逆反应速率),所以温度的改变是在100℃基础上升温(即T大于100℃) LiOH 2Cl-2e-=Cl2↑ 2Co(OH)3+4H++SO32-=2Co2++ SO42-+5H2O CoO2
【解析】Ⅰ.(1).100℃时,在0~60s时段,c(N2O4)由0.1mol·L1降到0.04mol·L1,所以v(N2O4)=(0.1000mol·L10.040mol·L1)÷60s =0.0010mol·L1·s1,在100℃时,反应达到平衡后,c(N2O4)及c(NO2)分别为0.040mol·L1、0.120mol·L1,所以平衡常数K=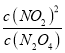 =(0.120mol·L1)2÷0.040mol·L1 =0.36mol·L1,故答案为:0.0010;0.36mol·L1;
=(0.120mol·L1)2÷0.040mol·L1 =0.36mol·L1,故答案为:0.0010;0.36mol·L1;
(2).对于反应N2O4(g)![]() 2NO2(g),温度升高,混合气体的颜色加深,说明升高温度平衡正向移动,则正反应为吸热反应,温度改为T后,c(N2O4)降低,则平衡向正反应方向移动,因正反应为吸热反应,所以是温度升高,即T大于100℃,故答案为:大于;正反应方向吸热,温度改变后平衡向正反应方向移动(正反应速率大于逆反应速率),所以温度的改变是在100℃基础上升温(即T大于100℃);
2NO2(g),温度升高,混合气体的颜色加深,说明升高温度平衡正向移动,则正反应为吸热反应,温度改为T后,c(N2O4)降低,则平衡向正反应方向移动,因正反应为吸热反应,所以是温度升高,即T大于100℃,故答案为:大于;正反应方向吸热,温度改变后平衡向正反应方向移动(正反应速率大于逆反应速率),所以温度的改变是在100℃基础上升温(即T大于100℃);
Ⅱ.(1).根据装置图可知,装置的B极区生成H2,同时产生OH-,则B极是阴极,因此阳离子(Li+)会经阳离子交换膜从A极区流向B极区,所以B极区的电解液为LiOH溶液;A极是阳极,阳极区的电解液为LiCl溶液,所以阳极的电极反应式为2Cl-2e-=Cl2↑,故答案为:LiOH;2Cl-2e-=Cl2↑;
(2).从流程图可知,钴渣[含Co(OH)3、Fe(OH)3等]中加入H2SO4、Na2SO3混合溶液后,生成了CoSO4等,所以Co(OH)3在酸溶并发生氧化还原反应时的离子方程式为:2Co(OH)3+4H++ SO32-=2Co2++SO42-+5H2O;假设在空气中煅烧CoC2O4生成的钴的氧化物为CoxOy,则根据题意得:
2xCoC2O4 + yO2 ![]() 2CoxOy + 4xCO2
2CoxOy + 4xCO2
2×(59x+16y)g 4x×22.4L
2.73g 1.344L
2×(59x+16y)×1.344L=4x×22.4L×2.73g,解得![]() =2∶1,所以在空气中煅烧CoC2O4生成的钴的氧化物为CoO2,故答案为:2Co(OH)3+4H++SO32-=2Co2++ SO42-+5H2O;CoO2。
=2∶1,所以在空气中煅烧CoC2O4生成的钴的氧化物为CoO2,故答案为:2Co(OH)3+4H++SO32-=2Co2++ SO42-+5H2O;CoO2。

 阅读快车系列答案
阅读快车系列答案【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
(1)9种元素中,化学性质最不活泼的是______,原子结构示意图为____________。
(2)这些元素中,最高价氧化物的水化物中碱性最强的碱是__________,写出元素![]() 的单质与其反应的离子方程式:___________________________________。
的单质与其反应的离子方程式:___________________________________。
(3)最高价氧化物是两性氧化物的元素是______ ,写出它的氧化物与NaOH溶液反应的化学反应方程式: ____________________________________ 。
(4)用电子式表示元素![]() 和
和![]() 组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”
组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”![]() 化合物。
化合物。



