题目内容
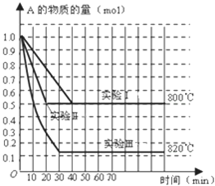 在一密闭容器中发生化学反应:2A(g)?B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法正确的是( )
在一密闭容器中发生化学反应:2A(g)?B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法正确的是( )| A、该反应正反应为放热反应 | B、实验Ⅱ和实验Ⅰ比较,实验Ⅱ一定使用了催化剂 | C、在实验Ⅰ中,若容器的体积为0.5L,则从开始到达平衡时间内B的平均反应速率为0.025mol/(L?min) | D、在800℃时,增大压强,若反应重新达平衡时混合气体对氢气的相对密度为64.5,则A的相对分子质量为129 |
分析:A、实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动;
B、实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的物质的量相同,但实验Ⅱ的反应速率快;
C、实验Ⅰ中,反应从开始至40min内A的浓度变化为
=1mol/L,再根据v=
计算;
D、反应是气体体积不变的反应,增大压强平衡不动,依据气体物质的量不变,质量不变分析;
B、实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的物质的量相同,但实验Ⅱ的反应速率快;
C、实验Ⅰ中,反应从开始至40min内A的浓度变化为
| 1mol-0.5mol |
| 0.5L |
| △c |
| △t |
D、反应是气体体积不变的反应,增大压强平衡不动,依据气体物质的量不变,质量不变分析;
解答:解:A、实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应,故A错误;
B、实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的物质的量相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但可以加快反应速率,缩短达到平衡时间,催化剂也可以加快反应速率,不改变平衡状态,故实验Ⅱ应该使用了催化剂或增大压强,故B错误;
C、实验Ⅰ中,达到平衡状态,反应至40min内A的浓度变化为
=1mol/L,B的浓度变化为0.5mol/L,所以v(B)=
=0.0125 mol?L-1?min-1,故C错误;
D、在800℃时,增大压强,平衡不动,若反应重新达平衡时混合气体对氢气的相对密度为64.5,混合气体平均摩尔质量=64.5×2=129,
2A(g)?B(g)+C(g);
起始量 1 0 0
变化量 0.5 0.25 0.25
平衡量 0.5 0.25 0.25
混合气体摩尔质量=
=129
则A的相对分子质量为129;
故D正确;
故选D.
B、实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的物质的量相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但可以加快反应速率,缩短达到平衡时间,催化剂也可以加快反应速率,不改变平衡状态,故实验Ⅱ应该使用了催化剂或增大压强,故B错误;
C、实验Ⅰ中,达到平衡状态,反应至40min内A的浓度变化为
| 1mol-0.5mol |
| 0.5L |
| 0.5mol/L |
| 40min |
D、在800℃时,增大压强,平衡不动,若反应重新达平衡时混合气体对氢气的相对密度为64.5,混合气体平均摩尔质量=64.5×2=129,
2A(g)?B(g)+C(g);
起始量 1 0 0
变化量 0.5 0.25 0.25
平衡量 0.5 0.25 0.25
混合气体摩尔质量=
| 1mol×MA |
| (0.5mol+0.25mol+0.25mol) |
则A的相对分子质量为129;
故D正确;
故选D.
点评:本题考查反应速率计算、外界条件对平衡的影响、化学平衡图象分析应用等,难度中等,注意改变压强,平衡不移动,掌握基础是关键.

练习册系列答案
相关题目
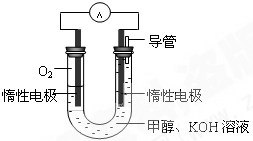 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题: