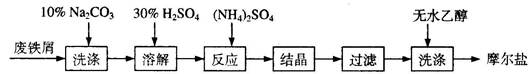
题目内容
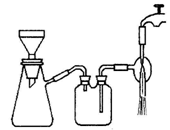
一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成.某校化学研究性学习小组对此进行研究.按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加.

试回答:
(1)装置A中需用浓H2SO4,用一种简单的方法确定一瓶H2SO4一定是浓H2SO4:
________________________________________________________________________.
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接__________、________接b,c接________、____________接d;D、E两支试管中CCl4溶液的作用是_____________________________________________________________________.
(3)能证明浓硫酸具有强氧化性的实验现象为_____________________________;
反应较长时间后气泡量又会明显增加的原因是___________________________
(4)D中浑浊消失的离子方程式为____________________________________

试回答:
(1)装置A中需用浓H2SO4,用一种简单的方法确定一瓶H2SO4一定是浓H2SO4:
________________________________________________________________________.
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接__________、________接b,c接________、____________接d;D、E两支试管中CCl4溶液的作用是_____________________________________________________________________.
(3)能证明浓硫酸具有强氧化性的实验现象为_____________________________;
反应较长时间后气泡量又会明显增加的原因是___________________________
(4)D中浑浊消失的离子方程式为____________________________________
(1)用火柴梗蘸取少量H2SO4,火柴梗若立即变黑,证明是浓H2SO4;用滴管吸取少量H2SO4,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4
(2)3或4 4或3 1 2 防倒吸
(3)C中品红溶液褪色 浓H2SO4变成稀H2SO4,与Zn反应放出H2
(4)SO2+H2O+CaSO3===Ca2++2HSO
(2)3或4 4或3 1 2 防倒吸
(3)C中品红溶液褪色 浓H2SO4变成稀H2SO4,与Zn反应放出H2
(4)SO2+H2O+CaSO3===Ca2++2HSO
(1)浓硫酸和稀硫酸的区别主要是体现在浓硫酸的三大特性上,即吸水性、脱水性和强氧化性。另外浓硫酸溶于水会放出大量的热,据此也可以进行鉴别。
(2)因为二氧化硫易溶于水,所以为了防止倒吸需先选择乙装置,然后才是甲装置。
(3)若浓硫酸具有强氧化性,则反应中生成的气体应是二氧化硫而不是氢气,所以品红溶液会褪色。随着反应的进行,硫酸的浓度会变稀,达到一定程度就会生成氢气。
(4)石灰水变混浊是因为生成了难溶于水的亚硫酸钙,但当二氧化硫过量时,亚硫酸钙会继续和二氧化硫反应生成可溶的亚硫酸氢钙。
(2)因为二氧化硫易溶于水,所以为了防止倒吸需先选择乙装置,然后才是甲装置。
(3)若浓硫酸具有强氧化性,则反应中生成的气体应是二氧化硫而不是氢气,所以品红溶液会褪色。随着反应的进行,硫酸的浓度会变稀,达到一定程度就会生成氢气。
(4)石灰水变混浊是因为生成了难溶于水的亚硫酸钙,但当二氧化硫过量时,亚硫酸钙会继续和二氧化硫反应生成可溶的亚硫酸氢钙。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目