题目内容
绿矾( FeSO4·7H2O )、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为: (NH4)2 SO4 + FeSO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O↓。其流程可表示为:
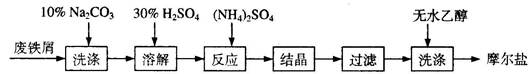
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热
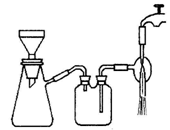
(3)过滤是用下图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00mL。
①本实验的指示剂是 。(填字母)
酚酞 B.甲基橙C.石蕊D.不需要
②产品中Fe2+的质量分数为 。

(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热
(3)过滤是用下图所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。

(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液10.00mL。
①本实验的指示剂是 。(填字母)
酚酞 B.甲基橙C.石蕊D.不需要
②产品中Fe2+的质量分数为 。
(1)利用碳酸钠溶液呈碱性,除去铁表面的油污(2分)
(2)加热到溶液表面出现晶膜时(2分)
(3)得到较干燥的沉淀(2分)
(4)除去水分,减少固体损失(2分)
(5)①D (2分) ②14% (2分)
(2)加热到溶液表面出现晶膜时(2分)
(3)得到较干燥的沉淀(2分)
(4)除去水分,减少固体损失(2分)
(5)①D (2分) ②14% (2分)
(1)碳酸钠溶液由于水解呈碱性,油脂在碱性条件下可水解为可溶于水的物质(高级脂肪酸钠盐及甘油),进而除去铁表面的油污
(2)浓缩的标准为:加热到溶液表面出现晶膜
(3)用布氏漏斗抽滤可加快过滤速率,得到较干燥的沉淀
(4)表面的水可溶于乙醇中,并且摩尔盐不溶于乙醇中,减小了产品的损失
(5)由于KMnO4溶液本身为紫色,当Fe2+全部被氧化达到终点时,紫色不在褪去即可
由关系式5Fe2+~2KMnO4可知,Fe2+的质量为:0.2×0.010×5×56=0.56g,Fe2+的质量分数为0.56/4=14%

练习册系列答案
相关题目