题目内容
(6分)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)===N2O4(g)
△H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是
(填字母)。
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是
(填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。则此温度下平衡常数K=____________
【答案】
(1)BC(2)-1224.96 kJ·mol-1(3)K=13.3
【解析】略

练习册系列答案
相关题目
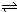 N2O4(g)达到平衡.
N2O4(g)达到平衡.