题目内容
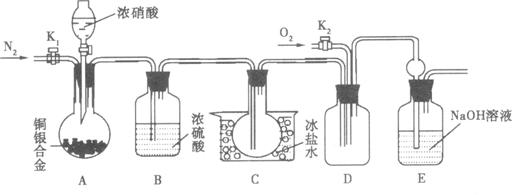
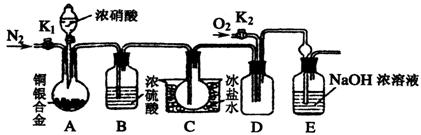
某研究性学习小组验证浓硝酸与铜银合金反应时除生成NO2气体外还会生成少量的NO气体。查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为此,他们设计了如下图所示的验证实验装置(图中略去了次要装置)
![]()
![]() 请回答下列问题:
请回答下列问题:
![]() (1)写出A瓶中铜与硝酸可能发生的反应方程式:
(1)写出A瓶中铜与硝酸可能发生的反应方程式:
![]() 、 。
、 。
![]() (2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
(2)实验开始时要先打开A中的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 ;装置中B瓶的作用是 。
![]() (3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO气体产生,则D中应出现的现象是 ;实验发现,通入氧气温度的高低对实验现象有较大影响,为了便于观察应通入 (填“冷”或“热”)的氧气。
![]() (4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
(4)已知合金的质量为ag,且合金完全溶解。若还想测定铜的质量分数,只需利用A装置中反应后的溶液进行简单的实验操作就可以过到目的,其实验过程为: 。
(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(2分)![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (2)排除装置内的空气,防止一氧化氮被氧化成二氧化氮(2分);吸收水蒸气,防止水蒸气在C中冷凝后与二氧化氮反应生成一氧化氮(2分)。
(2)排除装置内的空气,防止一氧化氮被氧化成二氧化氮(2分);吸收水蒸气,防止水蒸气在C中冷凝后与二氧化氮反应生成一氧化氮(2分)。
![]() (3)出现红棕色气体(1分);热(1分)
(3)出现红棕色气体(1分);热(1分)
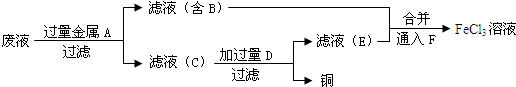
![]() (4)在A中加入过量的含Cl-的溶液,过滤、洗涤、干燥并称量沉淀的质量(3分)
(4)在A中加入过量的含Cl-的溶液,过滤、洗涤、干燥并称量沉淀的质量(3分)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案